Nature子刊:赵海艳/邓增钦团队解析猴痘病毒免疫逃逸蛋白作用机制
来源:生物世界 2023-09-04 11:50
综上,该研究揭示了正痘病毒中高度保守的免疫逃逸蛋白M2通过形成多聚体增强其和T细胞协同激活因子hB7.1/2的结合力(avidity),有效地阻断CD28与hB7.1/2互作,从而抑制T细胞活化的病毒
武汉大学病毒学国家重点实验室/生命科学学院赵海艳和中国科学院武汉病毒研究所邓增钦团队合作,在 Nature Communications 期刊发表了题为:Structural and functional insights into the modulation of T cell costimulation by monkeypox virus protein M2 的研究论文。
该研究解析了猴痘病毒M2通过抑制B7.1/2共刺激通路调节T细胞功能的机制,为痘病毒的免疫干预提供了新的思路和见解。

B7.1(CD80)和B7.2 (CD86)是主要表达在抗原递呈细胞(APC)表面的共刺激配体,与T细胞表面的共受体CD28或者CTLA4结合提供T细胞活化或者抑制的共刺激信号,调节T细胞的功能,维持机体的免疫平衡。许多感染性病原体和肿瘤可以通过调节B7.1/2-CD28/CTLA4信号通路,构建适宜的免疫抑制微环境,以获得更好的复制或存活。为了探索猴痘病毒的M2蛋白是否会通过拮抗B7.1/2介导的共刺激通路,从而逃逸T细胞介导的免疫反应。研究者首先利用重组表达的M2蛋白去检测M2是否可以与人的B7(hB7)家族成员互作,通过流式和生物层干涉技术(BLI)等发现重组表达的猴痘病毒和其他痘病毒的M2蛋白都可以特异性地结合B7家族中的hB7.1和hB7.2,而与B7家族中的其他蛋白(B7-H3等)并无明显互作。解析的MPXV M2-hB7.1/B7.2高分辨率复合物结构发现M2以同源六聚体和七聚体的环状形式存在,而hB7.1/2以1:1的比例结合在M2蛋白环的外侧。
结构分析发现M2在hB7.1/2的关键结合区域和CD28/CTLA4在hB7.1/2上的结合位点高度重叠,暗示M2可以竞争性地抑制CD28/CTLA4与hB7.1/2的互作。而细胞和竞争性BLI实验也进一步证明M2结合B7.1/2后可以阻断CD28/CTLA4与hB7.1/2的互作。
重要的是体外T细胞激活实验发现M2蛋白能够有效地抑制hB7.1/2介导的T细胞的激活。根据结构设计的M2单体虽然也能结合hB7.1/2,但其结合hB7.1/2的亲和力降低了近万倍,且M2单体几乎丧失了抑制T细胞激活的能力;说明M2的同源多聚化具有非常重要的生物学意义,是M2逃逸T细胞免疫反应的决定性因素(图1)。
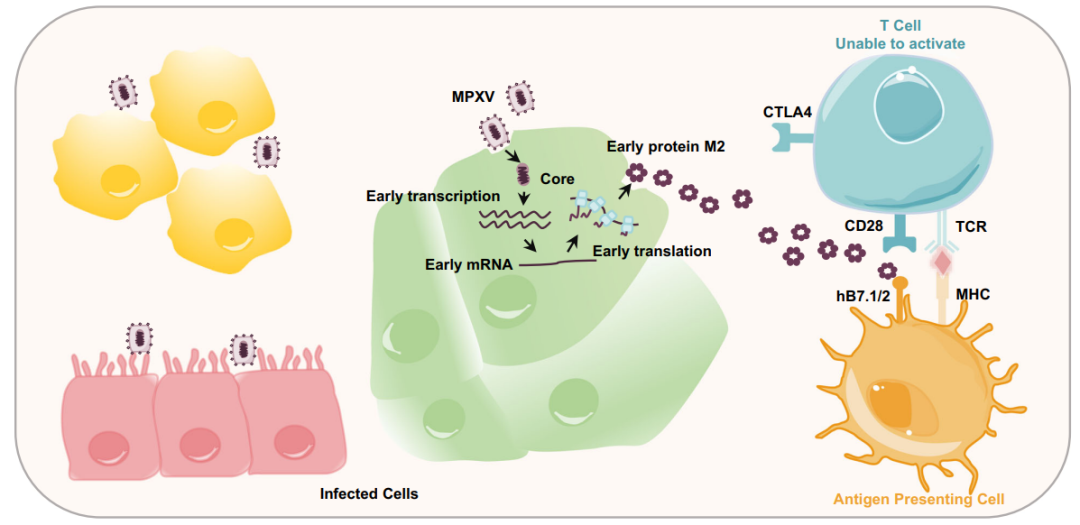
图1. MPXV M2抑制T细胞的激活
综上,该研究揭示了正痘病毒中高度保守的免疫逃逸蛋白M2通过形成多聚体增强其和T细胞协同激活因子hB7.1/2的结合力(avidity),有效地阻断CD28与hB7.1/2互作,从而抑制T细胞活化的病毒免疫逃逸机制。
武汉大学病毒学国家重点实验室/生命科学学院赵海艳研究员和中国科学院武汉病毒研究所邓增钦研究员为该论文的共同通讯作者。武汉大学生命科学学院硕士研究生杨尚予和博士研究生俞飞阳及中国科学院武汉病毒研究所的博士研究生王咏为论文的共同第一作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


