患上必死绝症后,夫妻俩转行研究朊病毒,开发新型表观基因编辑疗法,登上顶刊Science
来源:生物世界 2024-07-02 10:38
这项发表于 Science 的研究开发了一种全新的表观基因编辑器——CHARM,可以在大脑中可编程地靶向甲基化DNA,从而有效且持久地沉默靶基因。
2010年,Sonia Vallabh 目睹了自己52岁的母亲患上了一种快速进展、神秘且未确诊的痴呆症,并很快因此死亡,一年后,她得知自己的母亲患上的是一种遗传性朊病毒病——致命性家族性失眠。在接受基因检测后,Sonia 得知自己同样携带了PRNPD178N致病基因突变,这意味着她自己也很可能也会患上这种朊病毒病,更重要的是,这种致命性疾病通常在50岁左右发病并很快导致死亡,且仍然无药可医。
Sonia Vallabh 毕业于哈佛大学法学院,此时正在从事法律与咨询工作,而他的丈夫 Eric Minikel 正在麻省理工学院(MIT)进行城市规划与交通专业的硕士专业学习。不愿坐以待毙的他们,决定放弃当前的工作和学业,从零开始学习生命科学,致力于寻找和开发出能够阻止朊病毒病发生的方法。2015年,他们被哈佛大学医学院录取读博,2019年获得生物医学博士学位。在读博期间,他们发表了包括 Science Translational Medicine 、Nature 等在内的多篇高水平研究论文。此后,他们在Broad研究所建立了实验室,负责预防朊病毒药物研发项目。
2024年6月28日,Sonia Vallabh、Eric Minikel 与 Whitehead 研究所的蛋白质折叠专家 Jonathan Weissman 合作,在国际顶尖学术期刊 Science 上发表了题为:Brainwide silencing of prion protein by AAV-mediated delivery of an engineered compact epigenetic editor 的研究论文。
该研究开发了一种名为CHARM的紧凑型表观遗传沉默器,通过腺相关病毒(AAV)载体进行全身递送,能够有效关闭小鼠整个大脑中的朊病毒蛋白(PrP)的编码基因,而不会改变DNA序列。CHARM代表了一种全新的、基于表观遗传干预的治疗方式,可广泛应用于由不需要的蛋白质的毒性积聚引起的一系列疾病。

早在17世纪,就有关于羊瘙痒症的记载,以及众所周知的“疯牛病”、“僵尸鹿”,这些骇人听闻的疾病都是由朊病毒(Prion)引起的。
在人类中,已发现了4种朊病毒病——库鲁病、克-雅氏病、GSS综合征以及致死性家族性失眠症。这些致命性神经退行性疾病可自发出现,也可遗传,甚至可通过传播获得(例如同类相食)。所有的朊病毒病均由一个单一的分子机制导致。即都是由PRNP基因编码的朊病毒蛋白(PrP)的构象从其固有折叠形式(PrPC)到一种自我复制的错误折叠形式(PrPSc)变化引起的,这种错误折叠的朊病毒蛋白会引发毁灭性的神经退行性疾病。
虽然目前朊病毒病没有有效的治疗方法,但研究表明,降低实验动物大脑中的朊病毒蛋白水平可以阻止疾病进展,并且具有最有化的副作用。此外,朊病毒蛋白(PrP)在哺乳动物中是非必需的,因此,降低朊病毒蛋白在大脑中的表达水平是一种可行的治疗策略。
在这项最新研究中,研究团队设计了一种紧凑的、无蛋白酶组分的表观基因编辑器,称为CHARM——Coupled Histone tail for Autoinhibition Release of Methyltransferase(组蛋白尾部偶联实现甲基转移酶的自抑制释放 )。
通过将组蛋白H3尾部和非催化性Dnmt3l结构域的直接融合,CHARM能够招募并激活细胞内源性表达的DNA甲基转移酶,使靶基因甲基化。这一设计不仅可以极大地降低需要转入基因的大小,还可以显著降低细胞毒性。更重要的是,CHARM可以独立于KRAB转录抑制域起作用,并与多种DNA结合方式兼容,包括CRISPR-Cas系统、转录激活因子和锌指蛋白等。
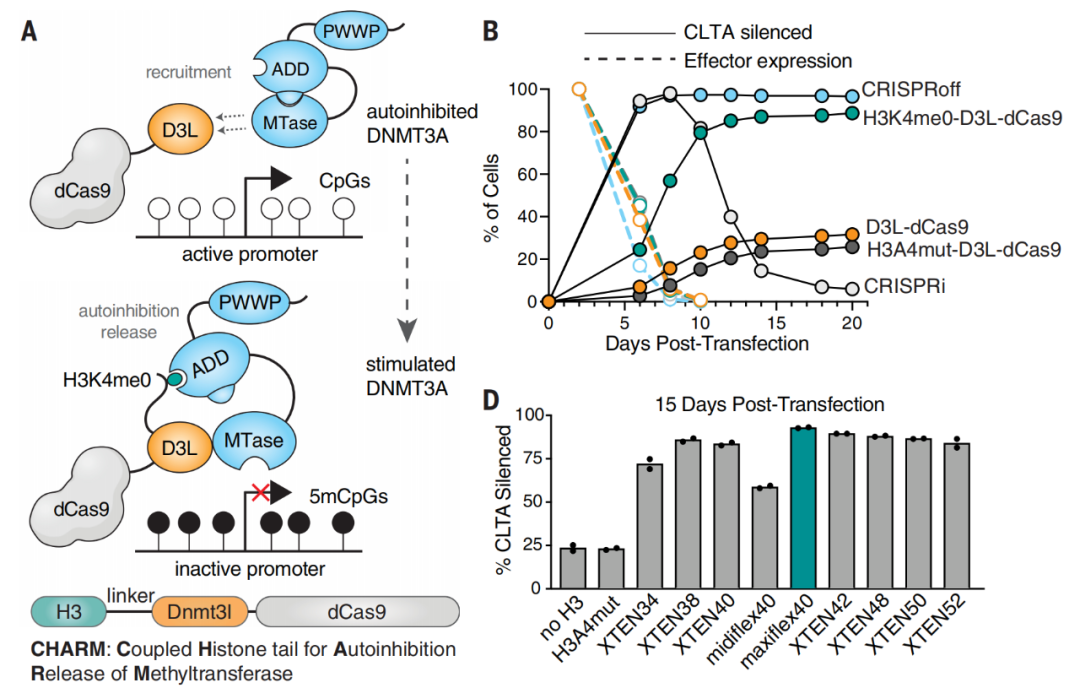
CHARM
腺相关病毒(AAV)载体是中枢神经系统的首选递送载体,具有安全性好、宿主细胞范围广和在体内长时间表达转基因等优点。
Jonathan Weissman 团队此前开发了基于CRISPR的表观基因编辑器——CRISPRoff,通过向目标基因添加甲基化,在不改变DNA的情况下实现,抑制基因表达出蛋白质。研究团队证实,该编辑器能够有效且稳定地抑制朊病毒蛋白基因的表达。
然而,对于AAV载体来说,CRISPRoff太大了,无法被单个腺相关病毒(AAV)载体容纳,这主要是因为其中Cas9占据了太大空间。
因此,研究团队开始设计一种新型表观基因编辑器,其具有足够小的尺寸,以便被单个AAV容纳,从而高效进入大脑并发挥作用。研究团队想到了比Cas9小得多的锌指蛋白(ZFP),与Cas9一样,锌指蛋白可以作为引导蛋白,将编辑器引导到目标基因位点,此外,锌指蛋白在人类细胞中也很常见,这意味着其与来自细菌的Cas9蛋白相比,不太可能引发免疫反应。
基于锌指蛋白(ZFP)的CHARM具有十分紧凑的尺寸,可在单个AAV载体中容纳多达三个DNA靶向元件,并为调控元件提供额外的空间,以赋予细胞类型特异性。
进一步研究表明,当与靶向朊病毒蛋白编码基因的锌指结构域偶联,并通过AAV递送到小鼠大脑时,CHARM使朊病毒基因启动子甲基化,使得小鼠全脑神经元朊病毒蛋白表达量降低80%,远超治疗所需的最低限度(此前的研究表明,只要消除21%的朊病毒蛋白,就能有效改善症状)。
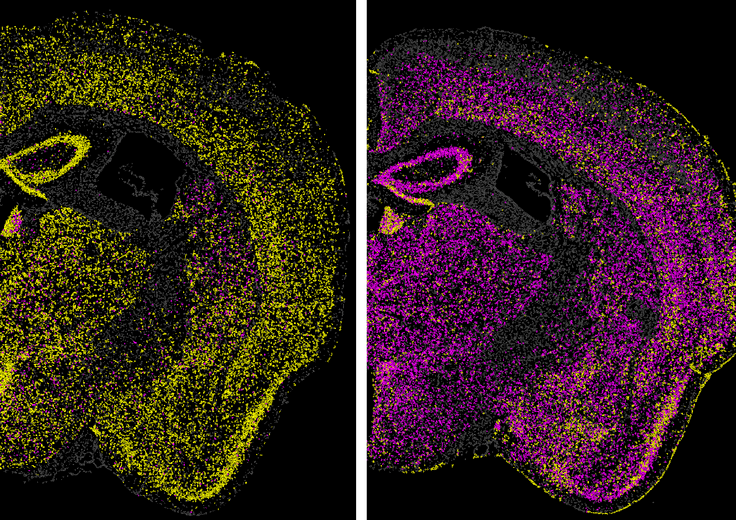
AAV递送的CHARM在小鼠体内沉默了PRNP基因表达,左图为治疗前,朊病毒蛋白表达呈阳性(黄色),右图为治疗后,朊病毒蛋白表达呈阴性(紫色)
不仅如此,研究团队还开发了自我沉默的CHARM,可以在沉默目标基因后自主关闭自身表达。这种负反馈设计防止了CHARM的过度表达,以避免在非分裂神经元中持续表达引起的潜在抗原性和脱靶活性。
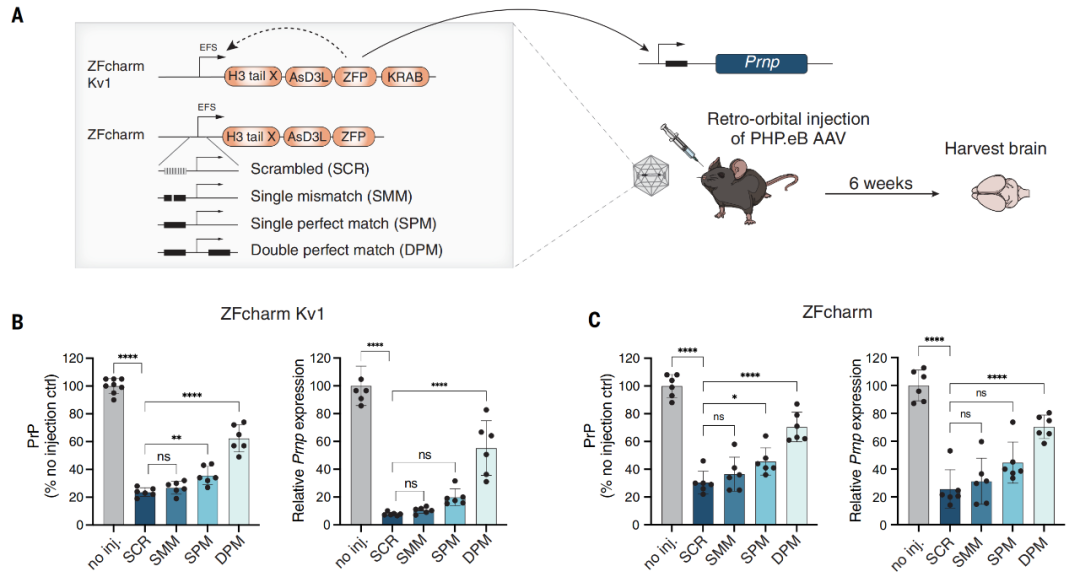
自我沉默的CHARM
总的来说,这项发表于 Science 的研究开发了一种全新的表观基因编辑器——CHARM,可以在大脑中可编程地靶向甲基化DNA,从而有效且持久地沉默靶基因。CHARM紧凑的小尺寸首次实现AVV介导的表观遗传编辑器的递送,其模块化设计实现了自我沉默策略,促进了多重靶向,并增强了与其他递送方式(例如LNP)的兼容性。
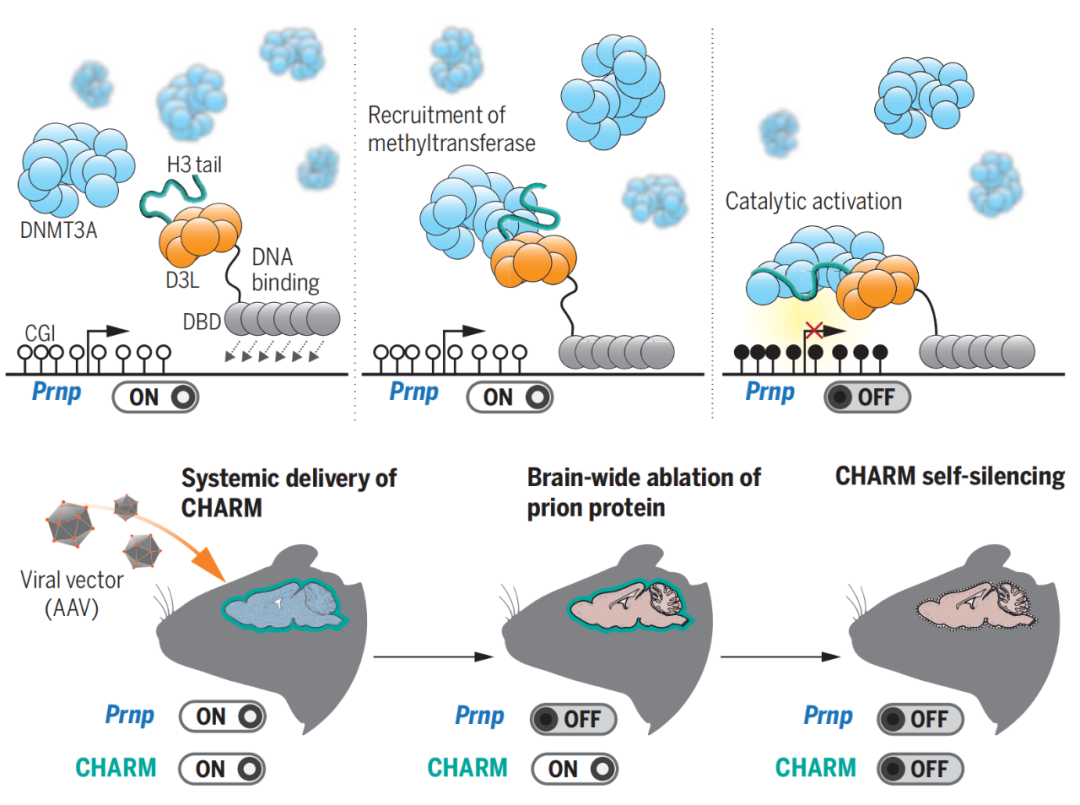
研究模式图
研究团队表示,这项研究工作为治疗朊病毒病以及与毒性蛋白聚集体积累相关的神经退行性疾病指明了新的方向。更通俗的说,CHARM将代表用于治疗干预和生物学发现的下一代表观遗传编辑器。
展望未来:
目前,研究团队正在对CHARM进行微调,以使其更有效、更安全且更易于大规模生产,这对于临床试验来说是必要的。他们已经将该表观基因编辑器进行了模块化设计,其各个组分都可以被替换,未来的CHARM不必从头开始编程。
从基础研究到临床试验的道路是漫长而曲折的,CHARM在成为朊病毒病等疾病的可行治疗选择之前,还有很长的路要走。但凭借强大的治疗设计和有希望的实验室结果,研究团队有充分的理由对未来充满希望。
研究团队表示,他们将继续全力以赴地工作,以尽快将这项技术应用于拯救患者的生命。 毕竟,现在已经40岁的 Sonia Vallabh ,留给她的时间不多了。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


