首都医科大学研究者们揭示了肿瘤细胞诱导的血小板聚集在肿瘤转移中的机制
来源:生物谷原创 2023-12-04 16:50
恶性黑色素瘤(MM)是全球癌症控制面临的严峻挑战,到2040年,其死亡率将上升至约68%。血流扩散以及随之而来的肺、脑或其他血液转移成为MM死亡的主要原因,其5年生存率为4.6%。
恶性黑色素瘤(MM)是全球癌症控制面临的严峻挑战,到2040年,其死亡率将上升至约68%。血流扩散以及随之而来的肺、脑或其他血液转移成为MM死亡的主要原因,其5年生存率为4.6%。免疫检查点抑制剂(ICIs)已被发现对多种恶性肿瘤具有决定性的预后益处。然而,超过一半的转移性MM伴血行转移的病例对ICIs反应不佳。寻找隐藏的目标,免疫逃逸加速已成为转移性MM治疗突破的关键。

图片来源: https://doi.org/10.1186/s13046-023-02856-1
近日,来自首都医科大学的研究者们在J Exp Clin Cancer Res.杂志上发表了题为“Tumor cell-induced platelet aggregation accelerates hematogenous metastasis of malignant melanoma by triggering macrophage recruitment”的文章,该研究表明肿瘤细胞诱导的血小板聚集(TCIPA)通过肿瘤诱导血小板(TEPs)加速MM肺转移,触发TAM募集,促进TAM极化(M2),重塑肺转移的抑制时间。
TCIPA不仅是公认的副肿瘤血小板增多的机制,而且是恶性黑色素瘤(MM)血液转移中免疫检查点抑制剂(ICIs)低反应的潜在突破性替代方案。然而,目前还没有TCIPA特异性的模型来进一步研究TCIPA与肿瘤免疫微环境(TIME)和转移之间的关系。
研究者建立了一个TCIPA转移性黑色素瘤模型,具有晚期血行转移和增强的TCIPA特征。研究者还研究了TCIPA的通路。研究发现TCIPA通过分泌B16细胞培养的血小板来源的趋化因子,如CCL2、SDF-1和IL-1β,触发肿瘤相关巨噬细胞(tam)向肺转移的募集。TCIPA模型中大量的TAMs通过B16细胞再加工被极化为M2型,其表面程序性细胞死亡1配体1 (PD-L1)表达上调,最终协助B16细胞逃避宿主免疫,加速MM血行转移。
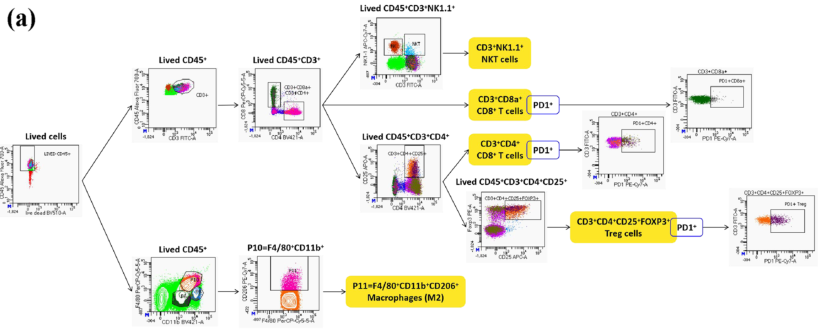
TCIPA改变巨噬细胞的表型和数量
图片来源: https://doi.org/10.1186/s13046-023-02856-1
综上所述,TCIPA通过释放CCL2、SDF-1、IL-1α和IL-1β来触发TAM募集,这些受体分别激活CCR2、CXCR4和IL-1R,刺激外周单核细胞募集到组织并分化为TAM。TCIPA模型中大量的tam通过B16细胞的再加工被极化为M2型,其表面PD-L1表达上调,最终帮助B16细胞逃避宿主免疫,加速黑色素瘤血行转移。靶向B16细胞教育的血小板可能为晚期黑色素瘤伴副肿瘤血小板增多症患者提供新的治疗策略。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


