《先进科学》:厦门大学医学院团队发现,高水平甘露糖促进阿尔茨海默病Aβ病理!
来源:奇点糕 2025-01-29 09:05
甘露糖能够通过改变β-和γ-分泌酶的BACE1和Nicastin的N-糖基化来影响神经元功能,从而促进Aβ斑块的产生,人体中的循环甘露糖水平过高可能与AD风险增加有关。
阿尔茨海默病(AD)的机制十分复杂,涵盖多个不同的生理过程。近年来,大脑能量失调与AD的关系得到了大量关注,有研究显示,碳水化合物的代谢效率进行性下降会使神经元更容易受到毒性损伤,产生功能障碍[1]。
大多数单糖可以穿过血脑屏障,通过糖酵解为大脑提供能量,尤其是五大单糖:D-葡萄糖、D-甘露糖、D-果糖、L-岩藻糖和L-半乳糖,其中D-葡萄糖已经有较为充分的研究,脑葡萄糖的代谢受损也被认为能够作为AD的标志物之一,通常在患者出现认知功能障碍前几十年就开始发生变化[2]。但目前其他单糖是否也有类似的作用还不清楚。
在最近的《先进科学》杂志上,厦门大学医学院的张杰教授和冷历歌教授带领团队发表了最新研究成果[3],他们发现,甘露糖也与AD的病理特征密切相关,过多的甘露糖会增加β-淀粉样蛋白(Aβ)复合,加剧认知障碍,从机制上来看,甘露糖通过N-糖基化增强了β和γ分泌酶亚基BACE1和Nicastrin的稳定性,从而促进Aβ产生。
这表明,高水平的甘露糖可能会使AD病理恶化,限制饮食中的甘露糖则可能具有治疗益处。

研究人员检查了7月龄的5xFAD小鼠和同窝对照的大脑和血清中五大单糖的水平,他们发现,与对照组相比,AD小鼠海马/皮层和血清中的葡萄糖和甘露糖水平均增加,其他单糖没有类似变化。进一步的分析显示,甘露糖和葡萄糖水平在AD相关的糖代谢变化中呈很强的正相关关系,变化趋势一致。
在临床确诊AD的患者中,相比年龄匹配的健康对照,血清中的甘露糖水平也要高得多。
这种差异及其与葡萄糖变化的一致性引起了研究人员的兴趣,他们尝试给6月龄的5xFAD小鼠的侧脑室直接注射甘露糖,结果显示,小鼠的淀粉样斑块负荷明显增加。
为了更好地模拟一般情况下的甘露糖摄入,他们给4月龄小鼠的饮用水中加入了20%的甘露糖,2个月后,小鼠的饮水量和体重没有变化,但认知行为测试显示小鼠的认知障碍加重。在野生型小鼠中,同样的甘露糖补充摄入也显示出了空间记忆能力的受损。
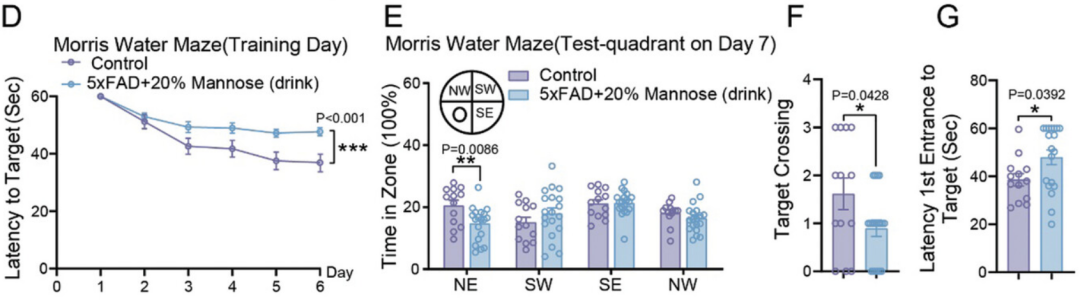
饮水中补充甘露糖(蓝)和对照(紫)小鼠的认知行为测试结果
反之,研究人员给小鼠定制了不含甘露糖的饮食计划后,5xFAD小鼠的海马/皮层和血清中甘露糖水平降低,认知测试中的学习和认知障碍减轻,运动能力、焦虑和抑郁样行为不受无甘露糖饮食的影响。小鼠大脑中的Aβ沉积显著减少。
给小鼠使用能够特异性阻断甘露糖转运的甘露糖类似物2,5-AM进行治疗,小鼠的认知障碍也能够显著减轻,Aβ沉积减少。
沉积的Aβ减少表明淀粉样前体蛋白(APP)的加工途径不受甘露糖的影响,同时,他们发现,无甘露糖饮食和2,5-AM治疗的小鼠的海马和皮层中BACE1和Nicastrin水平显著降低。
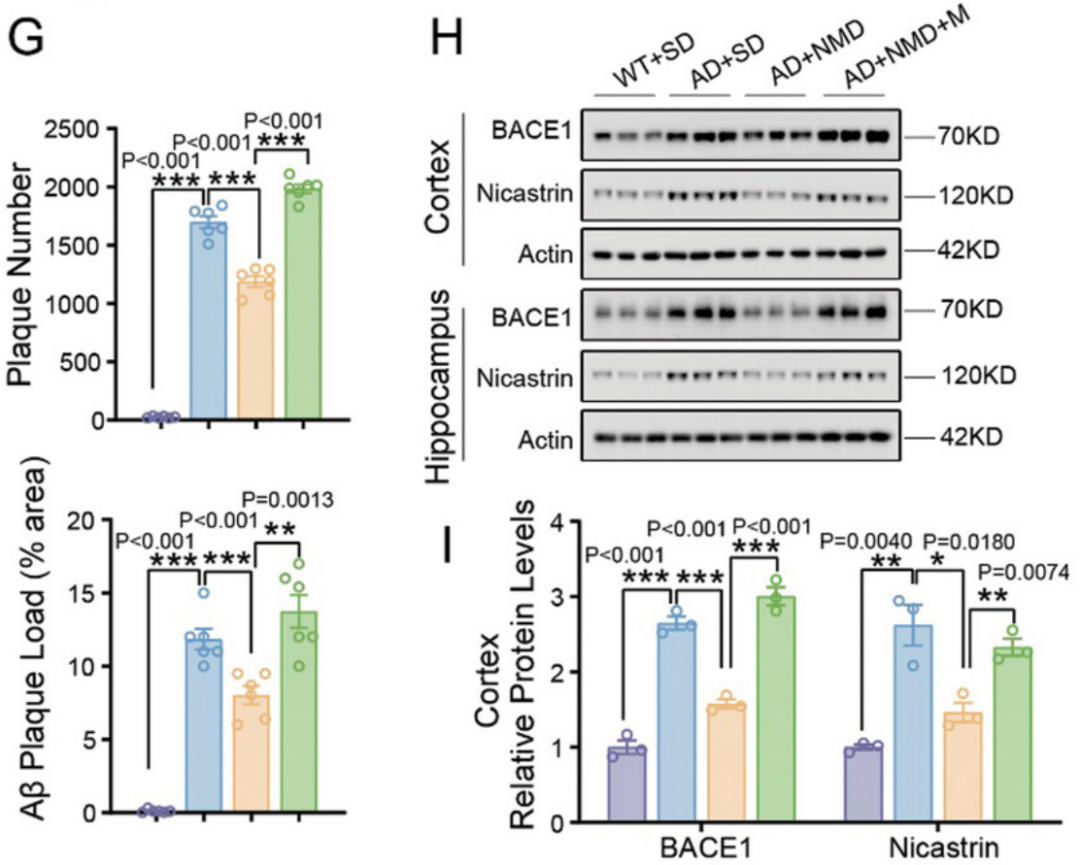
小鼠的斑块数量、负荷和BACE1和Nicastrin水平
对5xFAD小鼠和同窝对照的海马样本的单核DNA测序显示,甘露糖可能通过N-糖基化修饰影响神经元功能。甘露糖的主要功能之一就是通过调节糖酵解参与糖基化,AD小鼠相比健康小鼠,糖基化途径的主要代谢物显著增加,而无甘露糖饮食喂养则阻止了这种增加。
以前的研究显示,β-和γ-分泌酶的N-糖基化在AD中起重要作用。因此,研究人员使用α-甘露糖苷酶I抑制剂阻断了N-糖基化,这个操作显著阻断了BACE1和Nicastrin的糖基化修饰,并降低了它们在表达人APP基因的细胞中的蛋白质水平,表明BACE1和Nicastrin的糖基化可能影响它们的蛋白质稳定性。
通过直接补充甘露糖,研究人员发现,BACE1和Nicastrin的蛋白质稳定性确实显著增加,而使用α-甘露糖苷酶I抑制剂治疗5xFAD小鼠,显著减少了海马和皮层中的BACE1和Nicastrin蛋白质水平,以及淀粉样蛋白斑块负荷。
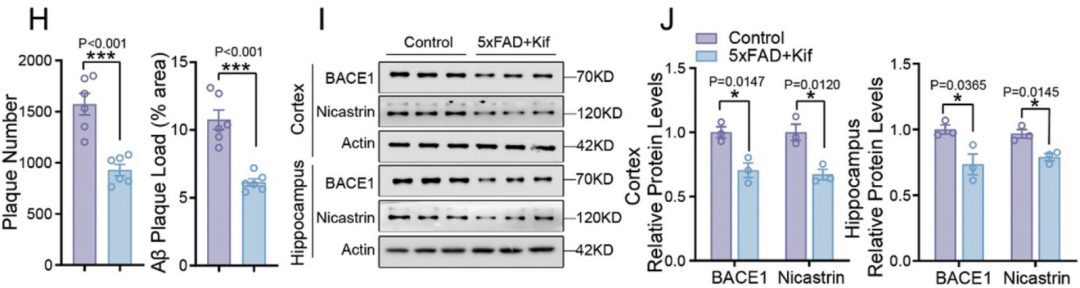
α-甘露糖苷酶I抑制剂治疗(蓝)和对照(紫)小鼠的斑块及BACE1和Nicastrin蛋白质水平
综上所述,甘露糖能够通过改变β-和γ-分泌酶的BACE1和Nicastin的N-糖基化来影响神经元功能,从而促进Aβ斑块的产生,人体中的循环甘露糖水平过高可能与AD风险增加有关。
D-甘露糖天然存在于各种水果中,包括蔓越莓、蓝莓、桃子和苹果等。此前的研究显示,甘露糖在一些疾病中具有有益作用,如癌症和炎症性疾病。尽管目前没有报告甘露糖对人类认知功能的有害影响,但本研究提示,有必要进行进一步的研究,以阐明甘露糖在不同生理和病理条件下的剂量-反应关系和长期神经认知影响。
[1] Vanni S, Colini Baldeschi A, Zattoni M, Legname G. Brain aging: A Ianus-faced player between health and neurodegeneration. J Neurosci Res. 2020;98(2):299-311. doi:10.1002/jnr.24379
[2] Butterfield DA, Halliwell B. Oxidative stress, dysfunctional glucose metabolism and Alzheimer disease. Nat Rev Neurosci. 2019;20(3):148-160. doi:10.1038/s41583-019-0132-6
[3] Liang C, Yuan Z, Yang S, et al. Mannose Promotes β-Amyloid Pathology by Regulating BACE1 Glycosylation in Alzheimer's Disease. Adv Sci. Published online January 14, 2025. doi:10.1002/advs.202409105
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


