探索新前沿 : 乳酸化修饰在心血管疾病中的革新之路
来源:网络 2024-07-29 10:00
乳酸不仅是糖酵解的副产物,而且是心脏的重要能量来源,可以通过参与线粒体氧化磷酸化代谢促进心脏ATP需求的实现,同时乳酸可能具有信号分子的能力,以丙酮酸依赖的方式参与TCA循环。
乳酸化检测这么强,我们不藏了!为助推研究者更好地利用奥斯卡DIA乳酸化组产品进行相关研究,现中科新生命和杭州微米生物联合推出“乳酸化组学百万支持计划”!该活动面向国内研究者征集乳酸化组学检测意向,并给予总额百万的项目支持。

心血管疾病 (CVD) 通常与结构和功能障碍有关,如心脏缺陷和循环功能障碍。心脏能量需求非常高,需要持续产生大量的ATP来维持其收缩能力。乳酸不仅是糖酵解的副产物,而且是心脏的重要能量来源,可以通过参与线粒体氧化磷酸化代谢促进心脏ATP需求的实现,同时乳酸可能具有信号分子的能力,以丙酮酸依赖的方式参与TCA循环。乳酸和乳酸衍生的乳酸化修饰显著影响心脏代谢紊乱,参与心血管疾病的发展。
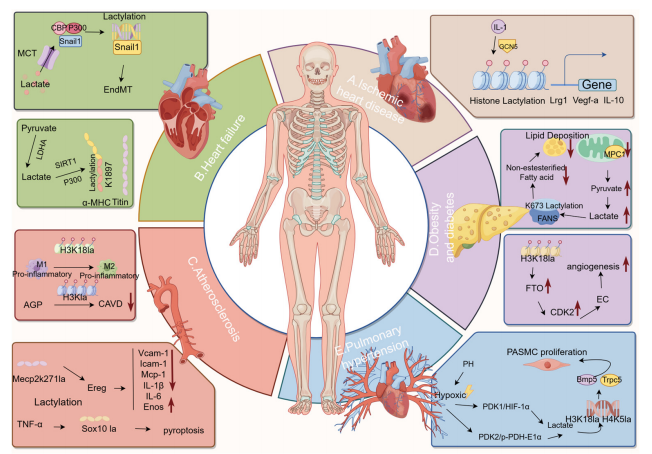
接下来小编将用3篇高分文章分析乳酸化修饰组学在心脑血管相关疾病研究中的应用思路。
01 乳酸化修饰调控心力衰竭新机制
2023年7月,中国医科大学附属第一医院孙英贤教授团队在Cell Research杂志上发表题为“α-myosin heavy chain lactylation maintains sarcomeric structure and function and alleviates the development of heart failure”的研究成果,利用蛋白质组和乳酸化修饰组发现心衰组织中乳酸显著降低,α-MHC K1897乳酸化以及α-MHC和Titin之间的相互作用显著降低,导致心力衰竭。

摘要
α-肌球蛋白重链(α-MHC)与Titin的相互作用对心脏结构和收缩至关重要。然而,在正常心脏和衰竭心脏中调节这种相互作用的机制尚不清楚。乳酸是心脏重要的能量基质。该研究发现α-MHC在赖氨酸1897位发生乳酸化修饰,以调节α-MHC与Titin的相互作用。在α-MHC K1897R突变小鼠中,K1897乳酸化缺失会降低α-MHC-Titin相互作用,导致心脏结构和功能受损。P300和Sirtuin 1分别作为α-MHC的酰基转移酶和去乳酸化酶。通过乳酸钠干预或抑制心肌细胞中关键乳酸转运蛋白上调乳酸浓度可促进α-MHC K1897的乳酸化和α-MHC-Titin相互作用,从而减轻心力衰竭。综上所述,心脏代谢通过α-MHC的乳酸依赖性修饰直接调节肌体结构和功能,为心力衰竭提供了的新治疗策略。
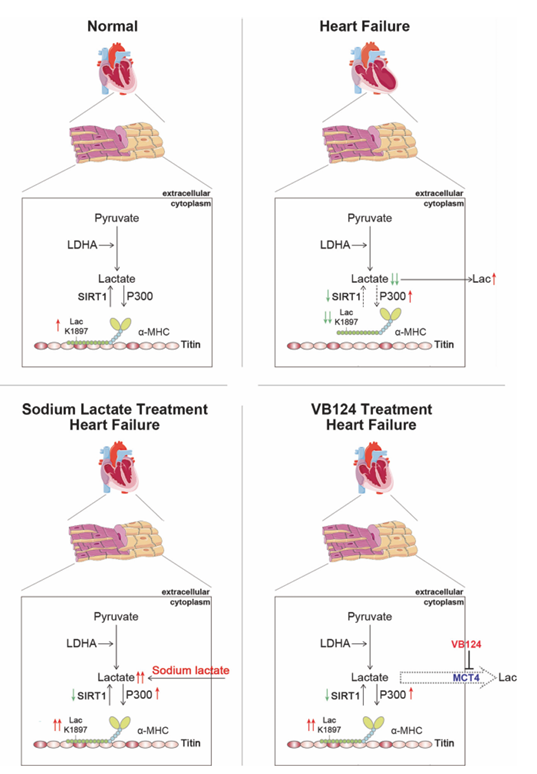
α-MHC乳酸化机理模型示意图
研究思路

02 孤儿核受体NR4A3调控组蛋白乳酸化促进血管钙化
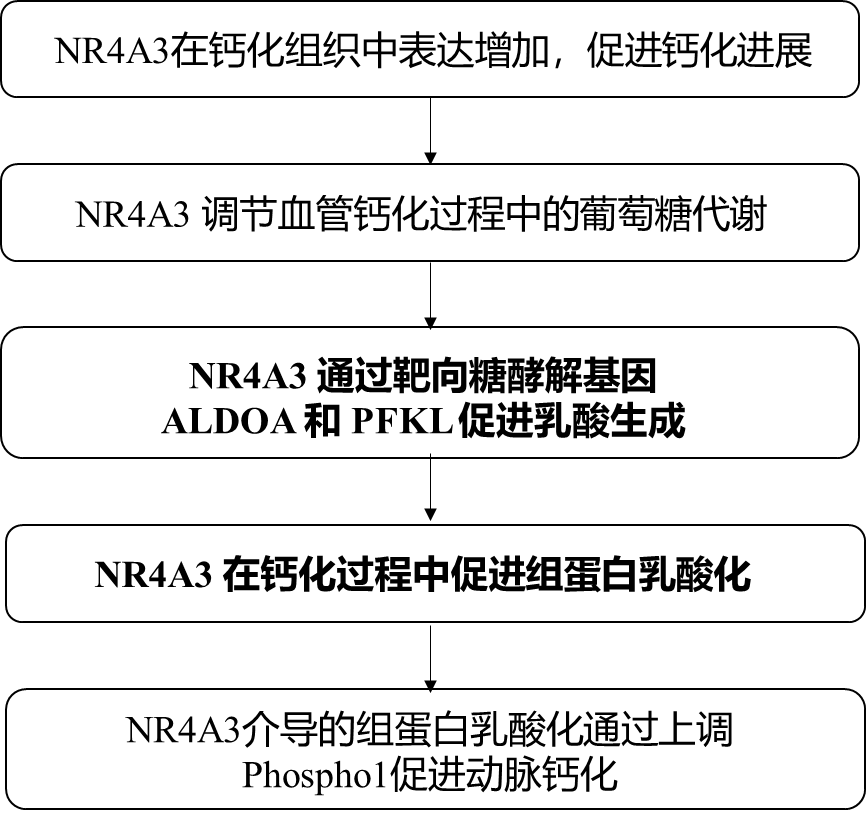
2024年4月,上海交通大学医学院附属瑞金医院闫小响、张瑞岩团队和首都医科大学附属北京安贞医院高霏副团队联合在Circulation Research杂志上发表了题为“Orphan Nuclear Receptor NR4A3 Promotes Vascular Calcification via Histone Lactylatio”的研究成果,通过整合多组学分析,发现介导生成的乳酸促进组蛋白H3K18乳酸化,激活Phospho1表达加速动脉钙化,靶向NR4A3介导的代谢组-表观基因组信号级联可能为预防动脉钙化提供新的见解。

摘要
内侧动脉钙化是一种不同于动脉粥样硬化的慢性全身性血管疾病,常见于慢性肾病、糖尿病和老年人。NR4A3是一种孤儿核受体,是载脂蛋白A-IV诱导的动脉粥样硬化进展的关键调节因子,但其在血管钙化中的作用尚不清楚。该研究在两种小鼠模型和人钙化主动脉组织中发现NR4A3表达上调。NR4A3缺乏降低了钙化过程中的糖酵解速率和乳酸生成,并抑制组蛋白乳酸化。机制研究进一步表明,NR4A3通过结合糖酵解基因ALDOA和PFKL的启动子区域并驱动其转录起始,从而增强糖酵解活性,增多的乳酸导致Phospho1启动子区域组蛋白H3K18位点乳酸化修饰升高,促进Phospho1的表达,从而促进钙化的发生发展。
研究思路
03 乳酸化修饰揭示视网膜小胶质细胞调控血管生成新机制
2023年4月,重庆医科大学附属第一医院侯胜平教授团队在Genome Biology杂志上发表了题为“YY1 lactylation in microglia promotes angiogenesis through transcription activation-mediated upregulation of FGF2”的研究成果,探究了缺氧、乳酸化和小胶质细胞介导的新生血管形成之间的调控机制,并为视网膜新生血管疾病提供了潜在的治疗靶点。

摘要
视网膜小胶质细胞与缺氧诱导的血管生成和血管病变有关,但其潜在机制尚不完全清楚。该研究通过乳酸化修饰组发现缺氧诱导67个蛋白中的77个乳酸化位点显著上调,其中转录因子YY1在K183位上发生乳酸化修饰,增强FGF2转录,促进血管生成。酰化修饰酶P300的过表达可以增加YY1的乳酸化水平,促进体外血管生成,其抑制剂可以抑制体内和体外血管形成。表明小胶质细胞中YY1的乳酸化通过上调FGF2的表达调控视网膜新生血管形成,靶向乳酸/P300/YY1乳酸化/FGF2轴可能为增殖性视网膜病变提供新的治疗靶点。

小胶质细胞中YY 1乳酸化促进血管生成的分子机制
研究思路

04 总结
乳酸是代谢失调与心血管疾病发病机制之间的关键环节。乳酸不仅作为代谢中间体发挥作用,而且还可作为信号分子发挥作用,参与心血管疾病的发展。乳酸化是一种新型的翻译后修饰,影响蛋白质功能和基因表达,从而在CVD发病机制中发挥重要作用。乳酸代谢和乳酸化为心血管疾病创新治疗靶点的探索提供了新思路。
关于中科新生命
上海中科新生命生物科技有限公司(APTBIO)成立于2004年,前身是原中国科学院上海生命科学研究院蛋白质组研究分析中心的对外服务平台。企业通过与国内外高等研究机构的技术合作和自有研发团队的创新能力组建了企业创新研究院,建立了大队列多组学研究技术平台、生物药物早研及临床前CMC研究分析平台、生物药及药械注册报批平台、AI大数据算法四大技术平台,布局科技服务、生物医药及大健康消费医疗CRO服务三大业务板块,构建了AI大数据结合质谱多组学技术应用的生命科学大健康商业版图。
作为大健康产业链上游创新引擎的科技服务事业部,以蛋白质组、修饰组、代谢及脂质组等质谱服务为核心,并延伸打造微生物、转录组等基因组以及单细胞蛋白、单细胞测序、空间转录组、空间代谢、空间蛋白等单细胞/空间多组学服务,已搭建出完整的创新型多组学平台。科技服务事业部在上海、浙江义乌两地设有近10000m2的实验室,多年来连续引进ThermoFisher、SCIEX、Bruker、10X等最先进的仪器设备近100台,秉承“创新为本,诚信为先、务实为要“的价值观,已助力全国上千所科研院校和医院客户发表3000+高水平SCI文章,累计影响因子20000+,为生命科学的发展提供坚实、专业、前沿的基础性研究。
联系我们
服务电话:021-54665263 400-066-6761
网址:www.aptbiotech.com
邮箱:marketing@aptbiotech.com.
联系地址:上海市闵行区园美路58号1号楼15 楼
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


