Mol Psych:清理“毒性”蛋白质团块或能有效预防人类痴呆症的发生
来源:生物谷原创 2022-11-21 17:00
来自昆士兰大学等机构的科学家们通过研究发现,清理细胞中的“蛋白质团块”(protein clumps)或能预防某些类别的痴呆症的发生。
近日,一篇发表在国际杂志Molecular Psychiatry上题为“Fyn nanoclustering requires switching to an open conformation and is enhanced by FTLD-Tau biomolecular condensates”的研究报告中,来自昆士兰大学等机构的科学家们通过研究发现,清理细胞中的“蛋白质团块”(protein clumps)或能预防某些类别的痴呆症的发生。
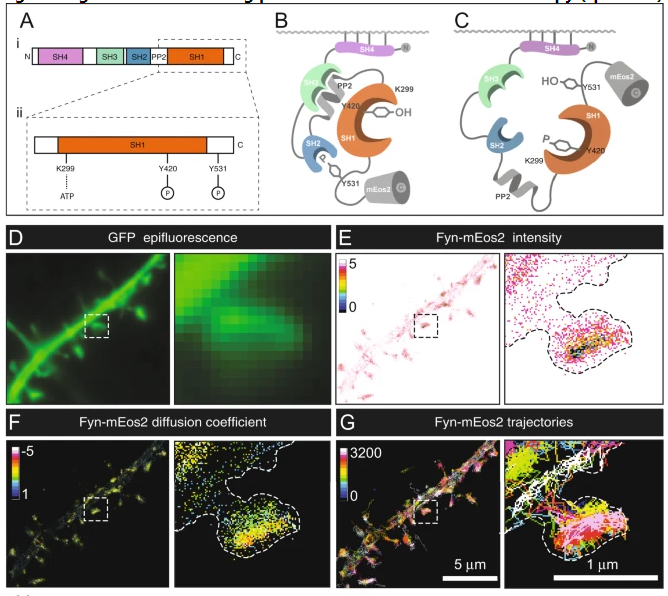
文章中,研究者表示,此前他们重点分析了额颞叶痴呆症(frontotemporal dementia)中名为Fyn的酶类与Tau蛋白之间的关联,Fyn对于机体学习和记忆非常重要,当其被固定在突触内时会变得高度活跃,而突触是连接神经元细胞之间的枢纽,也是神经元交流所发生的位点。如今利用超分辨率显微镜技术,研究人员就能实时分析这些酶类是如何在活体神经元中发生随机移动的。
研究者指出,当这些酶类处于活性状态下时,在其重新折叠并分散开始其循环之前,其会转变成为一种开放的结构(好像盛开的花朵一样),且会减缓其移动速度,并组合在一起形成聚集物或蛋白质团块。当其需要完成一个动作时,Fyn酶就会减缓速度并聚集在突触位点从而开启其功能。在正常情况下,这一过程在神经元之间的突触位点会自然发生数千次,其也是维持神经元交流的必要条件,而这或许就是学习和记忆发生的基础。
研究者Frederic Meunier解释道,为了让学习和记忆发生,Fyn需要形成这些动态集群,但如果你要以任何方式来改变你这种平衡的话,所形成的的动态集群就会太少或太多,这样机体就会出现病理学问题。这项研究基于研究人员此前的成果,此前他们发现,Tau蛋白会影响记忆功能中的一个关键机制,利用超分辨率显微镜进行分析后,研究者指出,在额颞叶痴呆症中,当神经元暴露于突变的Tau版本中时,Fyn酶类簇就会加剧从而引起一种微弱的连锁反应。
清理“毒性”蛋白质团块或能有效预防人类痴呆症的发生。
图片来源:Molecular Psychiatry (2022). DOI:10.1038/s41380-022-01825-y
如今来自全球各地的很多实验室都相继研究表明,Fyn和Tau之间的关联对于不同形式痴呆症的进展非常重要,包括阿尔兹海默病和额颞叶痴呆症等,然而,引起这些病理学相互作用背后的精确分子机制,研究人员也并不清楚。重要的是,这种Tau蛋白突变体会有更高的可能性形成所谓的生物分子凝聚体,即细胞内的一种小型凝胶样的液滴,一些蛋白质会在特定状况下趋向于自发聚集,从而形成类似于水溶液中溢出的液滴,而Tau蛋白就是其中的一种蛋白质;如果在神经元突触位点形成的话,这些Tau蛋白液滴就会为Fyn分子形成一种完美的陷阱,并促使其保持不动同时还能使其更长时间地保持聚集和激活。
研究者Martínez-Mármol博士表示,这就好像一张蜘蛛网,正常情况下,Fyn能停止和移动,移动和停止,在额颞叶痴呆症中,Fyn则会停止地更多,因为其会被卡在这种凝胶样的结构中,因此,Tau蛋白液滴就会在突触位点吸引额外的Fyn蛋白。这种Tau生物分子凝聚体或许就是逆转这种毒性连锁反应的关键;研究者认为其或许有望作为未来新型疗法的靶点来帮助重新建立正常的Fyn聚集动态特性,从理论上来讲,攻击毒性Tau生物分子凝聚体的形成或许就能预防痴呆症的发生。
综上,本文研究结果表明了Fyn蛋白会在封闭和开放的构象之间交替进行,而在其开放状态下其具有一定的酶类活性和聚集特性;此外,Fyn的致病性固定化或许依赖于P301L Tau蛋白所形成的生物分子凝聚体的能力,因此这就强调了液相分离在控制纳米聚集话以及下游细胞内信号事件中的重要性。(生物谷Bioon.com)
原始出处:
Martínez-Mármol, R., Small, C., Jiang, A. et al. Fyn nanoclustering requires switching to an open conformation and is enhanced by FTLD-Tau biomolecular condensates. Mol Psychiatry(2022). doi:10.1038/s41380-022-01825-y
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


