肝衰竭研究新突破!Cell Biol Toxicol:肝祖样细胞来源胞外囊泡可促进肝脏再生
来源:生物谷原创 2024-12-30 12:53
该研究表明肝细胞来源的肝祖样细胞分泌的细胞外囊泡(HepLPC-EVs)可通过传递miR-183-5p调节FoxO1/Akt/GSK3β/β-catenin信号通路,促进肝细胞增殖和肝脏再生。

肝脏作为人体的重要器官在代谢、解毒、合成蛋白质等方面发挥着不可或缺的作用。然而,急性肝衰竭(ALF)却如同一头凶猛的“病魔”,来势汹汹,严重威胁着患者的生命健康。ALF的病情进展极为迅速,肝细胞大量坏死,肝功能急剧恶化,常常引发多器官功能衰竭,死亡率极高。目前,原位肝移植虽然是较为有效的治疗手段,但供体短缺、手术禁忌证及并发症等问题,使得许多患者无法及时得到救治。因此,寻找新的治疗方法迫在眉睫。
近日,一项发表于Cell Biol Toxicol的研究Human liver progenitor-like cells-derived extracellular vesicles promote liver regeneration during acute liver failure为ALF的治疗带来了新的曙光。该研究发现,肝细胞来源的肝祖样细胞(HepLPCs)分泌的细胞外囊泡(EVs)在急性肝衰竭中具有显著的肝脏保护和再生促进作用,为ALF的治疗提供了全新的思路和潜在的治疗靶点。
一、HepLPC-EVs改善ALF小鼠生存与肝再生
研究人员首先从HepLPCs的条件培养基中成功分离出了细胞外囊泡(HepLPC-EVs),并对其进行了详细的表征分析。这些HepLPC-EVs呈圆形囊泡状,直径约100-150nm,具有典型的细胞外囊泡特征,表达EV相关蛋白CD63和外泌体特异性标志物TSG101。
为了探究HepLPC-EVs对ALF的治疗效果,研究团队构建了CCl₄诱导的ALF小鼠模型。将小鼠分为三组,分别通过尾静脉注射PBS、原代人肝细胞来源的EVs(PHH-EVs)和HepLPC-EVs。结果显示,注射HepLPC-EVs的小鼠肝脏组织病理损伤明显减轻,血清中ALT、AST等肝功能指标显著降低,炎症因子表达减少,生存率大幅提高。这表明HepLPC-EVs能够有效减轻肝脏损伤,促进肝脏再生,为ALF的治疗带来了希望。
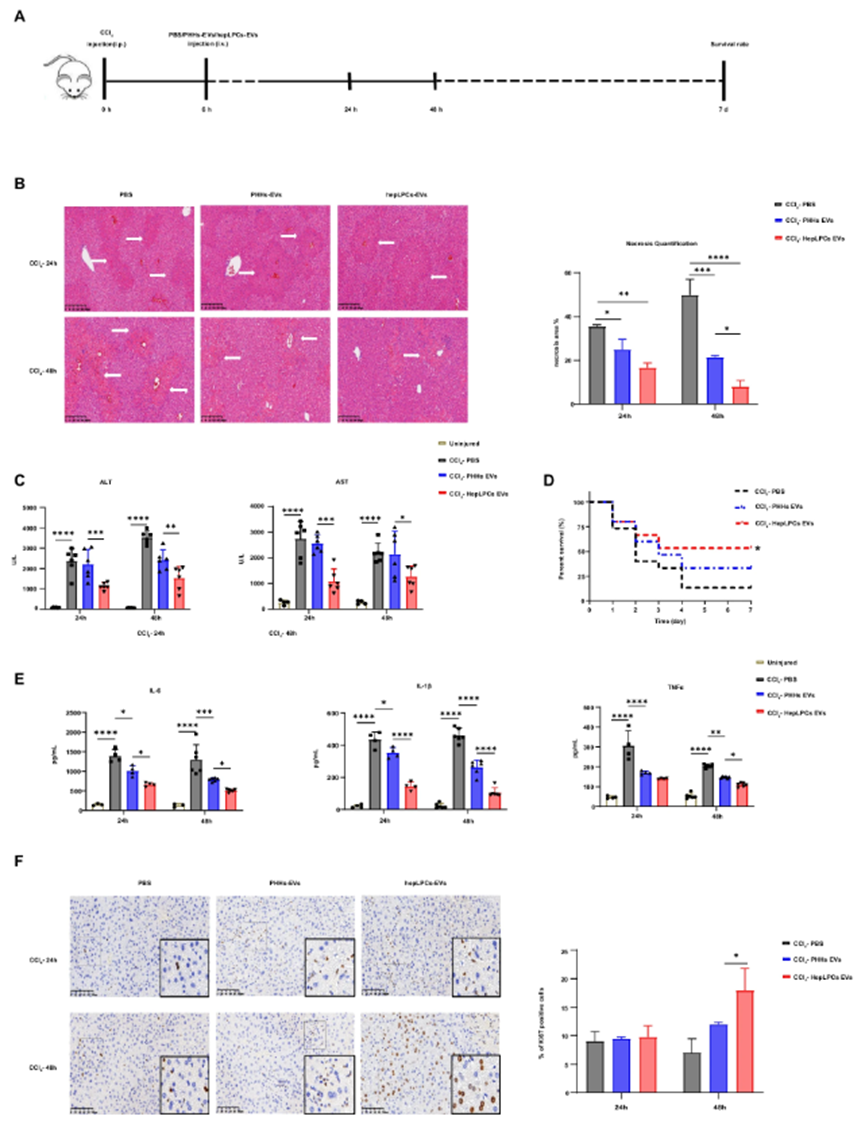
图1. HepLPC-EVs在ALF期间提高小鼠的存活率并促进肝脏再生
二、HepLPC-EVs促进肝细胞增殖的机制
进一步研究发现,HepLPC-EVs能够被原代肝细胞摄取,并在体外显著促进肝细胞增殖。通过一系列细胞实验,研究人员发现HepLPC-EVs可以增加肝细胞的EdU阳性细胞数量和Ki67共表达细胞数量,加速细胞周期进程,上调细胞周期相关基因cyclin A的表达,同时下调细胞周期抑制蛋白p27的表达。这些结果表明,HepLPC-EVs通过调节细胞周期相关蛋白的表达,促进了肝细胞的增殖。
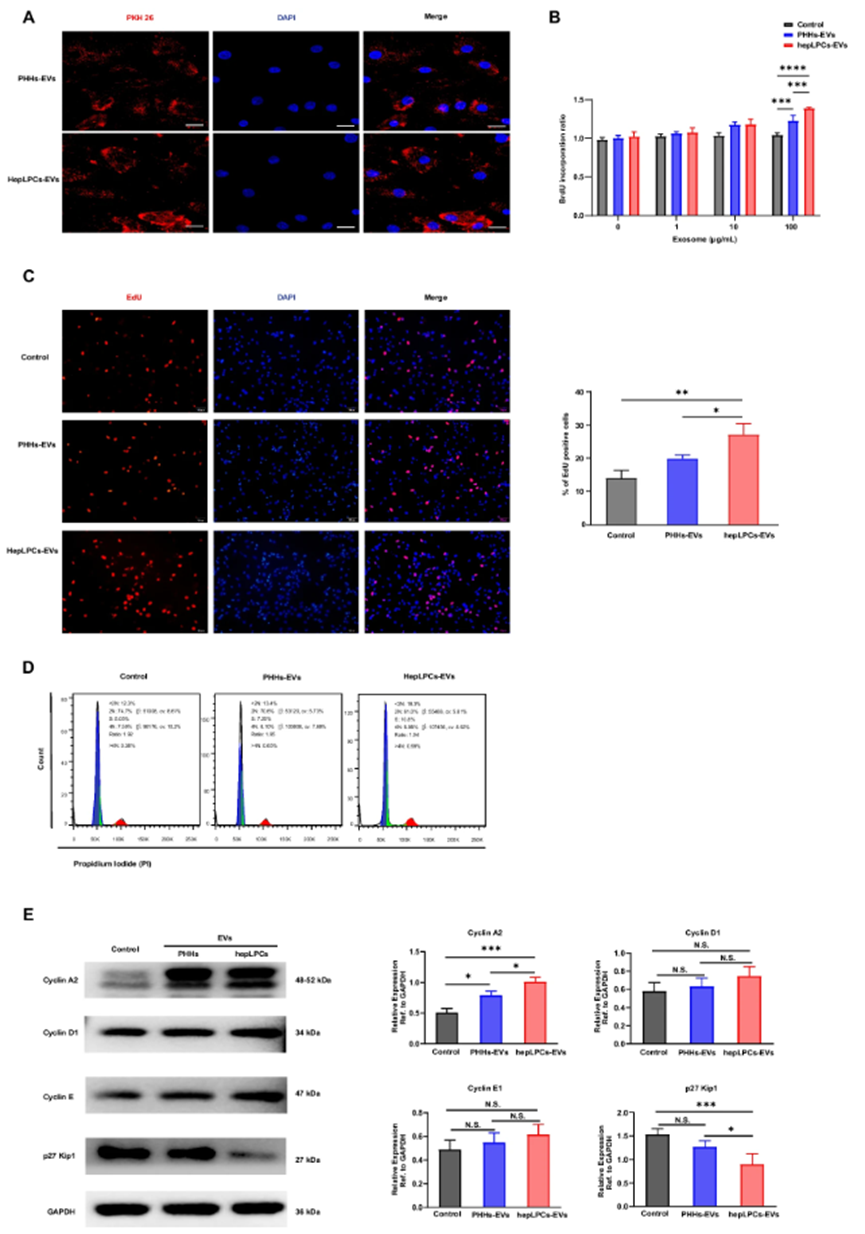
图2. HepLPC-EVs在体外促进肝细胞增殖
为了揭示HepLPC-EVs促进肝细胞增殖的分子机制,研究人员对HepLPC-EVs中的miRNA进行了深度测序分析。通过与PHH-EVs中的miRNA表达谱进行对比,筛选出了113个在HepLPC-EVs中表达上调的miRNA和60个表达下调的miRNA。生物信息学分析显示,这些差异表达的miRNA主要参与PI3K/Akt和AMPK等信号通路,与细胞增殖、代谢和存活密切相关。
在众多差异表达的miRNA中,研究人员聚焦于几个与肝再生相关的miRNA,如miR-183-5p、miR-182和miR-574等。经过进一步的实验验证,发现miR-183-5p在促进肝细胞增殖方面发挥着关键作用。miR-183-5p的模拟物能够显著增加肝细胞的增殖,而其抑制剂则抑制了肝细胞的增殖。
研究人员通过生物信息学预测和实验验证,发现miR-183-5p能够直接靶向抑制FoxO1基因的表达。FoxO1是一种重要的转录因子,参与细胞周期调控、细胞凋亡和代谢等多种生物学过程。miR-183-5p与FoxO1基因的3’-UTR区域结合,抑制其翻译过程,从而降低FoxO1蛋白的表达水平。
进一步研究表明,抑制FoxO1的表达能够激活Akt/GSK3β/β-catenin信号通路,促进细胞周期进程,增加肝细胞增殖。这一发现揭示了HepLPC-EVs通过传递miR-183-5p,调节FoxO1/Akt/GSK3β/β-catenin信号通路,从而促进肝细胞增殖和肝脏再生的分子机制。
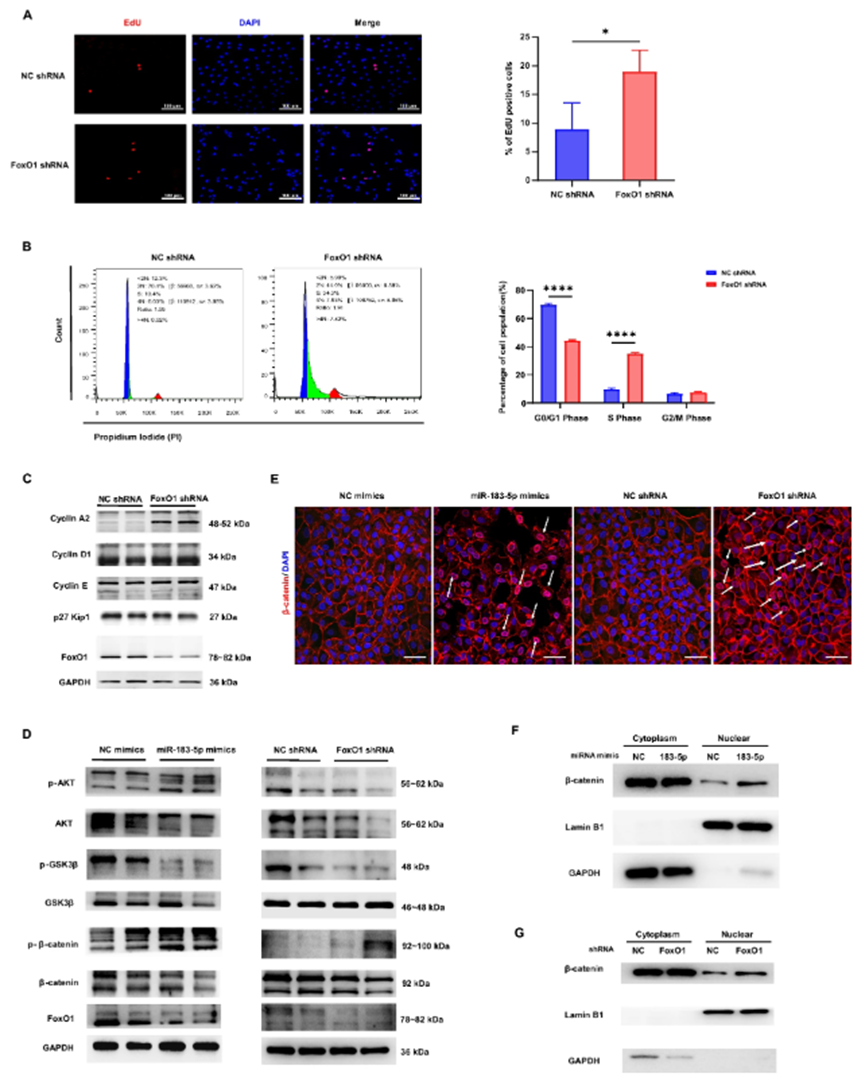
图3. miR-183-5p-FoxO1/Akt/GSK3β/β-catenin轴调节肝细胞增殖并促进肝脏再生
三、miR-183-5p在ALF小鼠体内的作用验证
为了验证miR-183-5p在体内的作用,研究人员在CCl₄和APAP诱导的ALF小鼠模型中,尾静脉注射miR-183-5p模拟物(agomir)。结果显示,miR-183-5pagomir治疗组小鼠的生存率显著提高,肝脏损伤减轻,肝功能指标改善,肝脏组织中Ki67阳性细胞数量增加。相反,敲低HepLPCs中的miR-183-5p后,HepLPC-EVs的治疗效果明显减弱。这进一步证实了miR-183-5p在HepLPC-EVs促进肝脏再生中的关键作用。
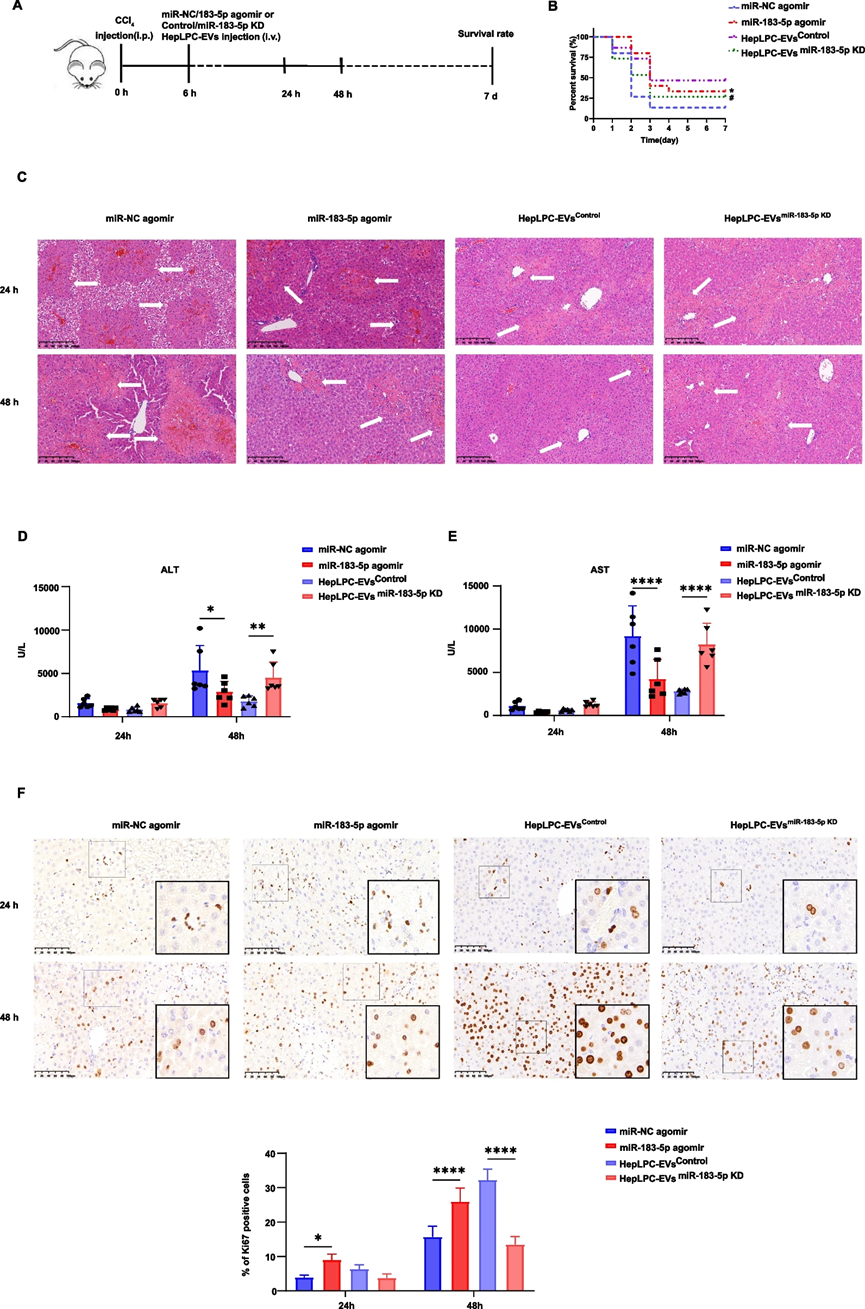
图4. miR-183-5p加速ALF小鼠的肝脏再生
总体而言,这项研究为急性肝衰竭的治疗提供了全新的思路和潜在的治疗靶点。HepLPC-EVs作为一种新型的细胞治疗手段,具有来源广泛、易于获取、免疫原性低等优点,有望成为治疗ALF的有效药物。未来,研究人员将进一步深入研究HepLPC-EVs的作用机制,优化其制备和应用方法,开展更多的临床前研究和临床试验,为最终攻克急性肝衰竭这一严重疾病奠定坚实的基础。(生物谷Bioon.com)
参考文献:
Chen Y, Wu Y, Sun H, et al. Human liver progenitor-like cells-derived extracellular vesicles promote liver regeneration during acute liver failure. Cell Biol Toxicol. 2024;40(1):106. Published 2024 Nov 28. doi:10.1007/s10565-024-09954-6
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


