2023年10月Cell期刊精华
来源:生物谷原创 2023-10-31 13:28
2023年10月份即将结束,10月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
2023年10月份即将结束,10月份Cell期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Cell:新研究首次构建出眼睛的蛋白质组时钟,有望开发出治疗眼病的新方法
doi:10.1016/j.cell.2023.09.012
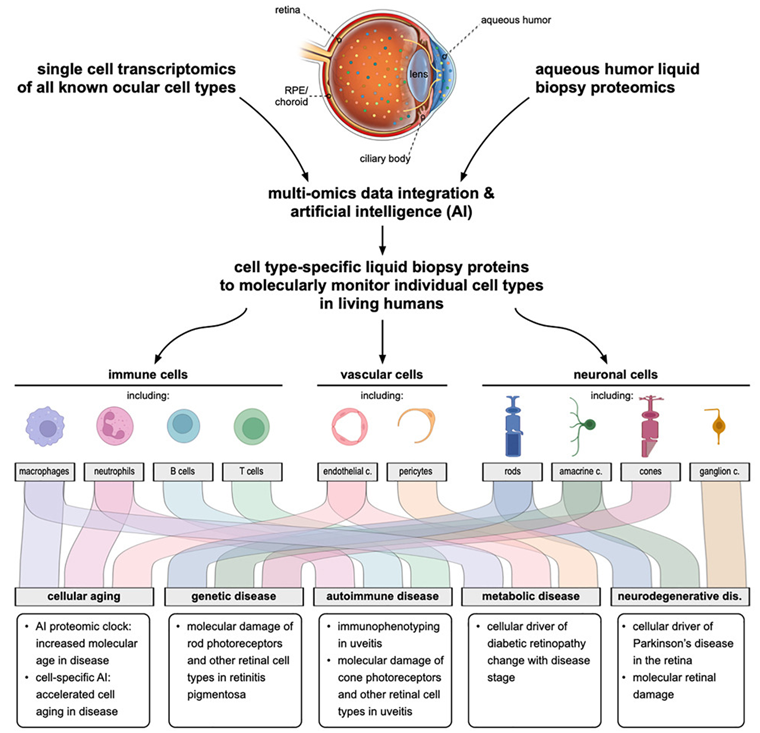
在一项新的研究中,来自美国斯坦福大学等研究机构的研究人员通过分析手术中常规取出的眼液小滴,绘制出了来自眼睛内不同细胞类型的近6000种蛋白的图谱。他们利用一种人工智能模型从这些数据中构建了一个“蛋白质组时钟(proteomic clock)”,该时钟可以根据健康人的蛋白图谱预测其年龄。相关研究结果于2023年10月19日在线发表在Cell期刊上,论文标题为“Liquid-biopsy proteomics combined with AI identifies cellular drivers of eye aging and disease in vivo”。
该时钟显示,糖尿病视网膜病变和葡萄膜炎等疾病会导致特定细胞类型加速衰老。令人惊讶的是,这些作者还在眼液中检测到了与帕金森病有关的蛋白,这可能为更早诊断帕金森病提供了一条途径。
图片来自Cell, 2023, doi:10.1016/j.cell.2023.09.012。
论文通讯作者、斯坦福大学眼科教授Vinit Mahajan说,“眼睛的神奇之处在于,我们可以观察内部,实时看到疾病的发生。我们的主要重点是将这些解剖学变化与患者眼睛内部分子水平的变化联系起来。”
为了绘制眼内不同类型细胞产生蛋白的图谱,Mahajan及其团队采用了一种高分辨率的方法,对从接受眼科手术的患者的玻璃体中提取的120份液体活检样本中的蛋白进行了表征。他们总共鉴定出了5953种蛋白,是以前类似研究中鉴定出的蛋白数量的十倍。利用他们开发的一款名为TEMPO的软件工具,他们能够将每种蛋白追溯到特定的细胞类型。
为了研究疾病与分子衰老(molecular aging)之间的关系,这些作者建立了一种人工智能机器学习模型,可以根据26种蛋白的一个子集预测眼睛的分子年龄。该模型能够准确预测健康眼睛的年龄,不过也显示疾病与明显的分子衰老有关。
2.Cell:结核分枝杆菌形成索状结构产生抗生素耐药性的生物物理机制
doi:10.1016/j.cell.2023.09.016
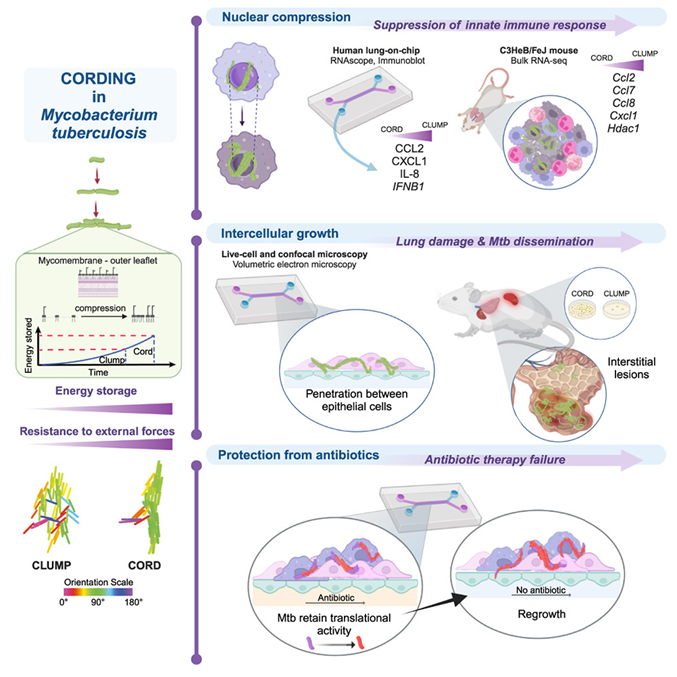
结核分枝杆菌(Mycobacterium tuberculosis, MTB),也称为结核杆菌,可导致严重的呼吸道传染病,近80年前,人们首次注意到它能形成蛇一样的索状结构。在一项新的研究中,来自德国海德堡大学和瑞士洛桑联邦理工学院等研究机构的研究人员报告了这种索状结构形成的生物物理机制,并展示了几代分裂的MTB细菌如何聚集在一起形成这些结构,从而产生抗生素耐药性。相关研究结果于2023年10月20日在线发表在Cell期刊上,论文标题为“Mechanopathology of biofilm-like Mycobacterium tuberculosis cords”。
论文通讯作者、海德堡大学的Vivek Thacker 说,“我们的研究清楚地表明,MTB索状结构的形成对感染很重要,以及为何这种高度有序的结构可能对致病机理很重要。”
图片来自Cell, 2023, doi:10.1016/j.cell.2023.09.016。
这项新的研究采用了一种独特的技术组合来研究所形成的MTB 索状结构的作用。其中的一种技术是肺芯片(lung-on-chip)模型,它使这些作者能够直接观察 MTB 与宿主细胞在肺部气液界面的“首次接触”。这揭示了这种索状结构在早期感染中起着至关重要的作用。他们还使用了一种会出现模拟人类肺结核的病理变化的小鼠模型,因此获得了可以使用共聚焦成像技术进行研究的组织,并证实了索状结构形成也发生在体内感染的早期。
这项新的研究获得了多项新发现,涉及这种索状结构如何与宿主细胞核相互作用并挤压细胞核、这种挤压如何影响免疫系统以及宿主细胞和上皮细胞之间的连接,以及这种索状结构的形成如何影响肺部中的肺泡。它还揭示了这种索状结构如何保持其结构的完整性,以及它们如何提高对抗生素治疗的耐受性。
论文共同第一作者、之前就职于洛桑联邦理工学院全球健康研究所而如今年就职于斯坦福大学的 Melanie Hannebelle 说,“人们越来越认识到,这些机械力会影响细胞的行为和反应,但由于传统的细胞培养模型无法再现组织的机械环境,因此这方面的研究一直被忽视。因此,了解细胞和组织层面的机械力或分子层面的拥挤如何影响细胞和组织的功能,对于全面了解生物系统的工作原理非常重要。”
3.蔡立慧团队研究进展!4篇Cell开创性研究揭示阿尔茨海默病的基因与分子机制
doi:10.1016/j.cell.2023.08.039; doi:10.1016/j.cell.2023.08.040; doi:10.1016/j.cell.2023.08.037; doi:10.1016/j.cell.2023.08.038
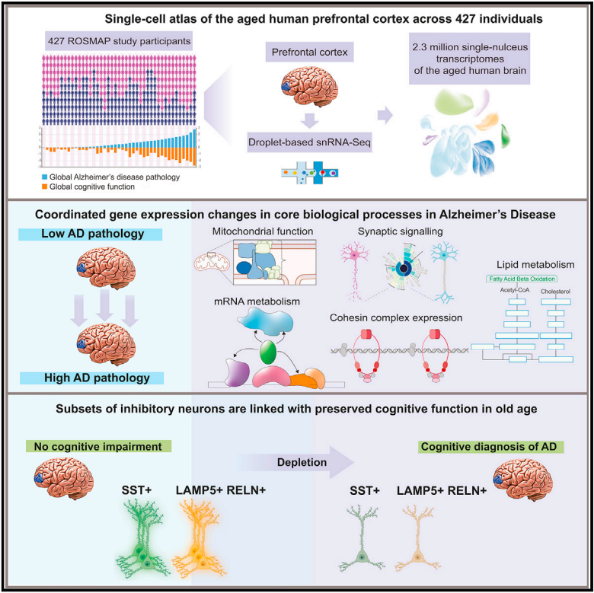
2023 年 9 月 28 日,由麻省理工学院学习与记忆研究所所长蔡立慧和麻省理工学院计算机科学与人工智能实验室 (CSAIL) 计算机科学教授马诺利斯·凯利斯领导的研究团队在Cell上发表了四篇重量级的论文报告了他们的发现,通过分析阿尔茨海默病中发生的表观基因组和基因表达变化,研究人员确定了可能成为新药物靶点的细胞途径。
研究人员使用来自 400 多个已故患者大脑样本的超过 200 万个细胞,分析了随着阿尔茨海默病的进展,基因表达如何受到破坏。他们还追踪了细胞表观基因组修饰的变化,这有助于确定特定细胞中哪些基因被打开或关闭。这些方法共同提供了迄今为止关于阿尔茨海默病的遗传和分子基础的最详细的图景。
在第一篇论文中,研究人员重点关注基因表达变化,通过使用单细胞 RNA 测序分析了这些样本中 54 种脑细胞的基因表达模式,并确定了阿尔茨海默氏症患者中受影响最严重的细胞功能。其中最突出的是,他们发现涉及线粒体功能、突触信号传导和维持基因组结构完整性所需的蛋白质复合物的基因表达受损,同时还发现与脂质代谢相关的遗传途径被高度破坏。
图片来自Cell,2023. doi:10.1016/j.cell.2023.08.039。
在第二篇论文中,研究人员研究了48名健康人和44名AD患者发生的一些表观基因组学变化。通过ATAC-Seq的技术,以单细胞分辨率测量了基因组上各个位点。通过将这些数据与单细胞RNA测序数据结合起来,就能够将关于基因表达程度与该基因有关的信息联系在一起,同时还能够追踪与先前与AD相关的基因中发生的基因表达和表观基因组的变化。他们确定了最有可能表达这些与疾病相关基因的细胞类型,发现其中许多最常出现在微胶质细胞中,这是负责清除大脑中碎片的免疫细胞。这项研究还揭示了随着AD的发展,大脑中的每种细胞类型都会经历一种被称为表观基因组侵蚀的现象,这意味着细胞正常的基因组位点模式会丧失,导致细胞身份的丧失。
在第三篇论文中,小胶质细胞的作用被重点关注,它占大脑细胞的 5% 到 10%。除了清除大脑中的碎片之外,这些免疫细胞还对损伤或感染做出反应,并帮助神经元相互沟通。他们发现随着AD的发展,更多的微胶质细胞进入炎症状态。蔡立慧实验室此前也曾显示,随着大脑内的炎症增加,血脑屏障开始破坏,神经元开始难以相互通信6。与此同时,AD患者的大脑中只有很少的微胶质细胞处于帮助大脑维持正常功能的状态。研究人员鉴定了保持微胶质细胞处于稳态状态的基因转录因子,蔡立慧实验室目前正在探索激活这些因子的方法,以期通过重新编程引发炎症的微胶质细胞切换回稳态状态来治疗AD。
在第四篇论文中,研究人员研究了DNA损伤如何导致AD的发展。蔡立慧团队之前的研究表明,早在阿尔茨海默病症状出现之前,神经元中就可能出现 DNA 损伤。这种损害的部分原因是在记忆形成过程中,神经元产生许多双链 DNA 断裂。这些断裂会迅速修复,但随着神经元老化,修复过程可能会出现故障。最新的研究显示,随着更多的 DNA 损伤在神经元中积累,它们修复损伤将变得更加困难,从而导致基因组重排和 3D 折叠缺陷,此外,这些修复错误还会导致一种称为基因融合的现象,当基因之间发生重排时就会发生这种现象,从而导致基因失调。除了基因组折叠缺陷之外,这些变化似乎主要影响与突触活动相关的基因,而这可能导致AD病人认知能力的下降。
4.Cell:揭示新冠病毒在受感染的宿主细胞中启动病毒复制机制
doi:10.1016/j.cell.2023.09.002
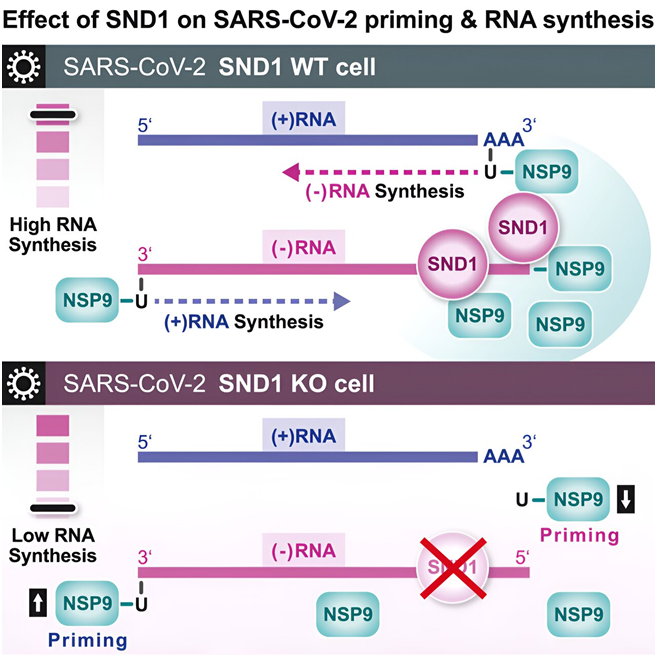
人们对 SARS-CoV-2 冠状病毒在感染过程中如何启动它的复制过程尚不完全清楚。在一项新的研究中,来自德国亥姆霍兹研究所等研究机构的研究人员首次发现人类蛋白 SND1 与SARS-CoV-2蛋白 NSP9 共同作用,激发了受感染细胞中的这种病毒基因复制程序。他们吃惊地发现,NSP9 是产生新病毒遗传物质的第一块基石。这些发现对进一步的基础研究意义重大,但也可能为治疗 COVID-19 和冠状病毒引起的其他传染病开辟新的途径。相关研究结果于2023年10月3日在线发表在Cell期刊上,论文标题为“SND1 binds SARS-CoV-2 negative-sense RNA and promotes viral RNA synthesis through NSP9”。
图片来自Cell, 2023, doi:10.1016/j.cell.2023.09.002。
在这项新的研究中,论文通讯作者Mathias Munschauer领导的一个研究团队重点研究了不同的 SARS-CoV-2 RNA 与人类宿主细胞蛋白之间的相互作用。
论文共同第一作者、Munschauer实验室博士后Nora Schmidt说,“我们发现,一种名为 SND1 的宿主蛋白能够识别一种特定类型的称为负链RNA的病毒 RNA。这种负链RNA 是扩增新病毒 RNA 分子的模板,但不会被翻译成蛋白。”
论文共同第一作者Yuanjie Wei高兴地报告说,“我们的研究发现了一个关键细节。在人类因子SND1的刺激下,这种病毒利用自身的蛋白NSP9作为引物,启动了RNA的产生。”
通过 SND1,这些作者描述了第一种被确认能够识别负链病毒 RNA 的宿主蛋白。他们还首次能够证实这种人类蛋白与 SARS-CoV-2 RNA 的结合及其与 NSP9 的相互作用有助于启动病毒复制。如果宿主因子 SND1 缺失,NSP9 启动病毒 RNA 合成的功能就会受损,病毒 RNA 的产生效率就会降低。
5.Cell:我国科学家在几种小型哺乳动物物种中发现病毒跨物种传播
doi:10.1016/j.cell.2023.08.029
在一项新的研究中,来自中国复旦大学、龙泉市疾病预防控制中心、武汉市疾病预防控制中心和温州市疾病预防控制中心等研究机构的研究人员探究了毛茸茸的小型病毒载体如何影响病毒的传播和进化。他们报告了669种病毒的鉴定结果,其中包括534种新型病毒,大大扩展了人们对哺乳动物病毒组(mammalian virome)---包括以前未知的冠状病毒和正腮腺炎病毒(orthorubulavirus)---的了解。相关研究结果发表在2023年10月12日的Cell期刊上,论文标题为“Host traits shape virome composition and virus transmission in wild small mammals”。
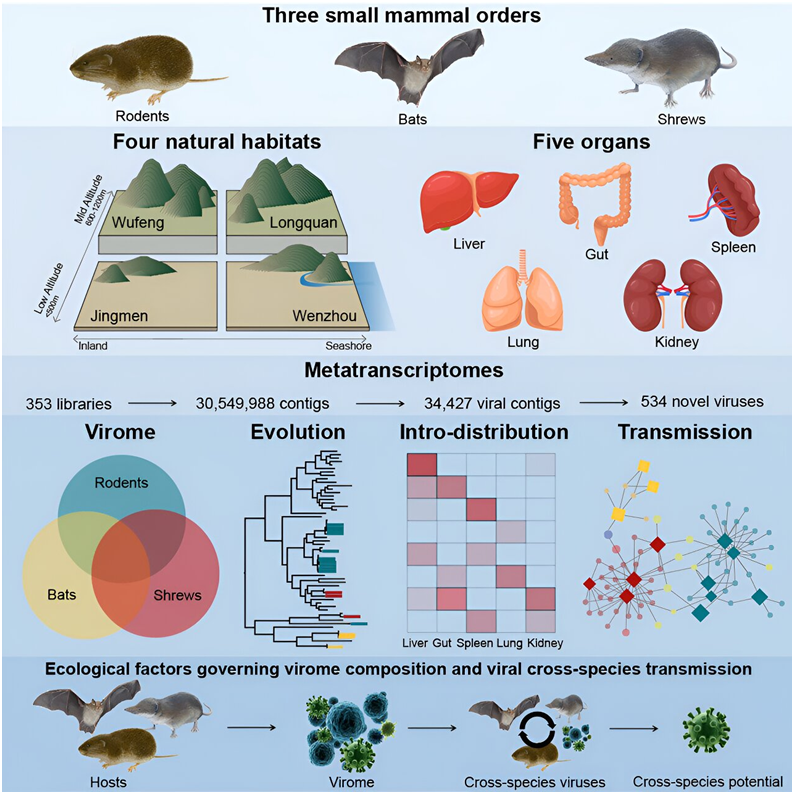
图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.029。
在这项新的研究中,这些作者利用宏转录组测序技术对来自中国四个栖息地的2443只野生蝙蝠、啮齿动物和鼩鼱的内脏器官和粪便样本进行了测序。几乎所有被研究的动物体内都发现了病毒。
这些作者发现了与已知人类或家养动物病原体---比如轮状病毒 A、汉城病毒(Seoul virus)、温州哺乳动物沙粒病毒(Wenzhou mammarenavirus)---相关的病毒,包括引起 SARS 和 COVID-19 等疾病的冠状病毒。此外,还有新发现的正腮腺炎病毒、猪流行性腹泻病毒(PEDV)、猪急性腹泻综合征冠状病毒(SADS-CoV)以及与 SARS 相关的冠状病毒。
这些作者提供了病毒跨物种传播的有力证据。例如,在多种野生小型哺乳动物体内发现了病毒,这表明这些病毒可以在不同动物物种之间传播,其中可能包括人类。
6.Cell:成功开发出基于AsCas12f的紧凑型基因组编辑工具
doi:10.1016/j.cell.2023.08.031
一种基于CRISPR的新型基因编辑工具已经开发出来,这可以为遗传疾病患者带来更好的治疗。这种工具是一种名为AsCas12f的酶,经过基因修饰后具有相同的功效,但体积只有常用于基因编辑的Cas9酶的三分之一。体积小巧意味着可以将更多的这种酶装入病毒载体,然后递送到活细胞中,从而提高效率。
在一项新的研究中,来自日本东京大学、京都府立医科大学和自治医科大学等研究机构的研究人员构建出了一个可能的AsCas12f突变文库,然后将选定的突变组合在一起,设计出一种AsCas12f酶,其编辑能力是原始未突变类型的10倍。这种经过改进的 AsCas12f 已成功地在小鼠身上进行了测试,未来有可能开发出一种在患者体内使用的更有效的新疗法。相关研究结果近期发表在Cell期刊上,论文标题为“An AsCas12f-based compact genome-editing tool derived by deep mutational scanning and structural analysis”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.031。
这些作者从 Axidibacillus sulfuroxidans 细菌中选取了一种名为 AsCas12f 的酶。这种酶的优势在于它是迄今发现的最紧凑的 Cas 酶之一,体积不到 Cas9 的三分之一。然而,在之前的测试中,它在人类细胞中几乎没有表现出任何基因组编辑活性。
Nureki 解释说,“我们使用一种叫做深度突变扫描(deep mutational scanning)的筛选方法,将AsCas12f的每个氨基酸残基都替换成所有生命赖以生存的20种氨基酸之一,从而组建了一个潜在的新候选突变文库。由此,我们确定了 200 多种可增强基因组编辑活性的突变。”
Nureki解释,“根据从AsCas12f结构分析中获得的新见解,我们选择并组合了这些活性增强的氨基酸突变,从而构建了一种改进的AsCas12f。这种改进的AsCas12f的基因组编辑活性是普通型AsCas12f的10倍以上,与Cas9相当,但体积却小得多。”
这些作者已经对这种改进的AsCas12f系统进行了动物实验,将它与其他基因配对,递送到活体小鼠体内。与提取细胞、在实验室中对这些细胞进行编辑并将它们重新给送到患者体内相比,直接在患者体内递送这种改进的AsCas12f系统更可取。
7.Cell:感染新冠病毒的婴幼儿产生的抗体反应可持续长达300天
doi:10.1016/j.cell.2023.08.044
在一项新的研究中,来自德国图宾根大学、美国斯坦福大学、埃默里大学和辛辛那提儿童医院医学中心的研究人员研究了婴儿在出生后最初几个月感染冠状病毒SARS-CoV-2 后的免疫反应。他们发现感染这种冠状病毒的婴幼儿产生的持久抗体反应可持续长达300天。相关研究结果发表在2023年10月12日的Cell期刊上,论文标题为“Multi-omics analysis of mucosal and systemic immunity to SARS-CoV-2 after birth”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.044。
这些作者从辛辛那提儿童医院医学中心IMPRINT 队列中的婴幼儿身上采集了血液和鼻拭子样本。这些儿童每周接受一次 SARS-CoV-2 检测,该队列中包括 54 名受感染的婴幼儿,其中包括 27 名具有配对感染前样本的婴儿。另外 27 名配对的对照婴幼儿代表健康对照组,他们从出生到采样期间的SARS-CoV-2检测结果均为阴性。
除IMPRINT 队列外,这些作者还从埃默里大学希望诊所和斯坦福大学医学中心采集了 48 名 COVID-19 成年患者的 62 份血液样本和 10 份健康对照样本。此外,还从 41 名患有轻度 COVID-19 的母亲(包括 3名具有感染前配对样本和 3 名具有配对对照样本)那里获得了血液样本。
与成人相比,婴幼儿对 SARS-CoV-2 表现出强大而持久的抗体反应。这些抗体滴度在长达 300 天的时间里一直保持较高水平,而成人的抗体反应衰减得更快。
在血液中,儿童先天性细胞的活化标志物上调,但炎症细胞因子没有明显增加。婴儿的记忆 B 细胞和 T 细胞反应明显低于成人。不过,他们的多功能辅助性T细胞 17(Th17)和 1 型 CD4+ T 细胞有所增加,其特点是产生白细胞介素-2(IL-2)、γ 干扰素和肿瘤坏死因子α,使其呈现三重阳性。
8.Cell:精氨酸或能驱动癌细胞的代谢重编程从而促进肝癌的进展
doi:10.1016/j.cell.2023.09.011
癌细胞是变色龙,其会完全改变代谢状况从而不断生长,近日,一篇发表在国际杂志Cell上题为“Arginine reprograms metabolism in liver cancer via RBM39”的研究报告中,来自瑞士巴塞尔大学等机构的科学家们通过研究发现,高水平的氨基酸—精氨酸或能驱动代谢重编程从而促进肿瘤生长,相关研究结果有望帮助开发改善人类肝癌治疗的新型疗法。
健康的肝脏细胞在转变为癌细胞时会逐渐改变其行为,其会重新编程代谢来尽可能更快地生长,也会摄入比正常细胞需求更多的葡萄糖并增强对营养物质的摄取。研究者Dirk Mossmann博士说道,我们对来自小鼠和患者机体的肝脏肿瘤样本进行调查分析,结果发现了肿瘤样本中的精氨酸水平会升高,尽管癌细胞很少或基本不产生精氨酸,肿瘤细胞会通过增加对精氨酸的摄入并抑制其消耗从而积累高水平的精氨酸。
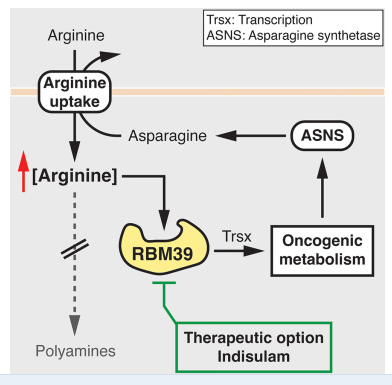
精氨酸或能驱动癌细胞的代谢重编程从而促进肝癌的进展。图片来源:Cell (2023). DOI:10.1016/j.cell.2023.09.011
此外,研究人员还发现,高水平的精氨酸是肿瘤发生的必要条件,而与精氨酸在蛋白质合成中的作用无关;这就引出了一个问题,即精氨酸是如何导致肿瘤发生的呢?在高浓度下,精氨酸能结合特殊因子从而通过调节代谢基因的表达来诱发细胞的代谢重编程并促进肿瘤的生长,因此,肿瘤细胞会恢复到未分化的胚胎细胞状态,在这种状态下其就会无限分裂,有意识的是,肿瘤细胞还能通过另一种方式从增加精氨酸的摄入来获益。研究者说道,我们的免疫细胞依赖精氨酸来正常发挥功能,因此,在肿瘤环境中剔除精氨酸或能帮助肿瘤细胞躲避免疫系统的狙杀。那么这些发现对于癌症疗法有什么意义呢?科学家们认为通过靶向作用特定的精氨酸结合因子而不是消耗精氨酸或许能给患者的治疗带来一定的益处。
研究者Mossmann说道,在使用抗癌药物indisulam治疗肝脏肿瘤时,我们就能诱导该因子发生降解并阻止代谢重编程的发生,通过这一途径,研究人员就能避免降低整体的精氨酸水平所产生的不必要的副作用,比如损伤需要精氨酸来正常发挥功能的免疫细胞。此外,诸如增加精氨酸的水平等代谢改变或许也能作为在早期阶段检测癌症的特殊生物标志物,这对于癌症的成功治疗和患者的生存至关重要。
9.Cell:有意思!揭示脑瘤促使特定免疫细胞转变为“叛徒”背后的分子机制!
doi:10.1016/j.cell.2023.08.043
中性粒细胞是机体血液循环中较为丰富的免疫细胞,其会经常大量浸润肿瘤,然而,其在不同癌症类型中的确切功能目前研究人员并不清楚,包括在大脑中的微环境中的功能。近日,一篇发表在国际杂志Cell上题为“The local microenvironment drives activation of neutrophils in human brain tumors”的研究报告中,来自瑞士洛桑大学等机构的科学家们通过研究首次全面分析了位于大脑肿瘤中的中性粒细胞,包括在大脑内部自身形成的胶质瘤,以及从肺部、乳腺和皮肤扩散到大脑中的癌症等。
研究人员分析了中性粒细胞在大脑转移性癌症和胶质瘤中的优先空间生境、动力学特性、基因表达模式和其功能状态,值得注意的是,他们识别出了肿瘤微环境中特殊的细胞相互作用和一对分子因子,这些因子对于将中性粒细胞从潜在的抗肿瘤免疫因子转化成为恶性肿瘤的教唆者非常关键。这是这项研究最令人兴奋的发现之一,因为只有一小部分的大脑转移性癌症会对当前可用的免疫疗法产生反应,而胶质瘤已被证明对所有类型的疗法都会产生耐受性。研究人员在肿瘤微环境中识别出了能将中性粒细胞转化为免疫抑制和促肿瘤制剂的特定细胞和分子因子,这或许就有望帮助他们开发新型治疗方法来促使脑癌更容易对免疫疗法变得易感。
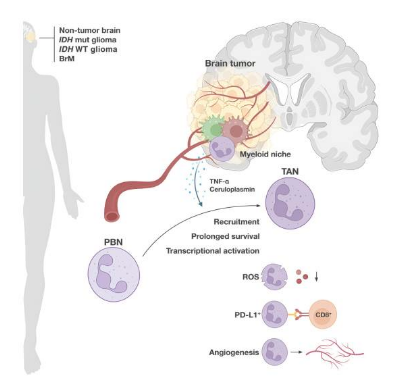
揭示脑瘤促使特定免疫细胞转变为“叛徒”背后的分子机制。图片来源:Cell (2023). DOI:10.1016/j.cell.2023.08.043
癌症往往依赖于一群非癌细胞来生存和生长,而脑瘤也不例外;在探索脑癌生物学方面,研究者Joyce的实验室近些年来广泛分析胶质瘤和大脑转移性癌症的免疫蓝图,并识别出新型策略来解决其复发和对疗法的耐受性问题。目前他们的大部分工作都集中在骨髓免疫细胞上,最值得注意的就是巨噬细胞和其在大脑中的常驻细胞—小胶质细胞,Joyce及其同事还在这些研究中观察到,中性粒细胞(骨髓细胞)会在脑瘤中大量积累,尤其是在胶质瘤和大脑转移性癌症的恶性形式中,这或许就引发了其在肿瘤进展中所扮演的潜在角色等一系列问题。当前的研究就回答了这些问题,文章中,研究人员对来自患者机体的190多酚脑瘤样本和多种脑癌小鼠模型进行了综合性的多因素分析,结果发现,在大脑转移性癌症中,中性粒细胞的丰度要比在原发性胶质瘤中更高,然而,在所有肿瘤类型中,其表型(或物理特性和功能状态)与循环和健康的大脑组织中的中性粒细胞或许有着显著的差异。
研究人员表示,肿瘤相关的中性粒细胞(TANs,tumor-associated neutrophils)倾向于聚集在肿瘤中畸形和渗漏的血管周围,并能关闭诱导细胞死亡的基因表达程序,同时还会开启促进细胞生存的基因,从而延长细胞的寿命,这些研究发现在脑癌小鼠模型的开创性研究中得到了证实。研究人员发现,一旦被安置在肿瘤微环境中,TANs就会开始产生刺激血管形成的因子,其功能也会受到抑制,从而减缓活性氧自由基的产生,这种分子是中性粒细胞用来摧毁细胞靶点的特殊分子。事实证明,TANs不仅仅是免疫抑制的受害者,其同时也是肇事者,研究者发现,聚集在肿瘤血管周围的TANs或许细胞毒性T细胞有关,同时也会抑制其功能,而细胞毒性T细胞能作为免疫系统的一线力量,并能杀灭癌细胞,目前大多数获批的免疫疗法都与此有关。
10.Cell:揭示蛋白的固有无序区在染色质调控和基因表达中发挥着核心作用
doi:10.1016/j.cell.2023.08.032
根据教科书,蛋白的工作原理是折叠成稳定的三维形状,就像乐高积木一样,与其他生物大分子精确配合。然而,蛋白这个“生物学的主力”的形象是不完整的。大约一半的蛋白上都挂着无序的氨基酸片段,这些片段被称为“固有无序区(intrinsically disordered region, IDR)”。由于IDR具有更动态、更“形状多变”的几何形状,生物学家普遍认为它们不能像折叠的氨基酸片段那样与其他生物大分子精确配合,因此认为它们对蛋白整体功能的贡献可能不那么显著。
如今,在一项新的研究中,来自美国丹娜-法伯癌症研究所、哈佛医学院、普林斯顿大学和华盛顿大学等研究机构的研究人员揭示了IDR如何控制细胞生物学的一个关键方面。他们指出IDR具有特殊而重要的相互作用,在染色质调控和基因表达中发挥着核心作用,而染色质调控和基因表达是每个活细胞的基本过程。相关研究结果于2023年10月2日在线发表在Cell期刊上,论文标题为“A disordered region controls cBAF activity via condensation and partner recruitment”。

图片来自Cell, 2023, doi:10.1016/j.cell.2023.08.032。
这些作者重点研究了人类cBAF复合物的无序区域,其中这种复合物是细胞核中的一组多组分蛋白,其作用是打开细胞内染色质中密集卷曲的DNA,使基因沿着DNA表达并转化为蛋白。cBAF亚基家族ARID1A和ARID1B中的IDR突变在癌症和神经发育疾病中非常常见,从而使得染色质重塑和基因表达失调,这表明IDR不是微不足道的额外部分。
特别地,这些作者发现IDR形成的称为凝结物(condensate)的小液滴会从周围的细胞液中分离出来,就像水中的油滴一样。在这些凝结物中发生的特殊相互作用使得蛋白和其他生物大分子聚集在特定位置,以执行细胞活动。虽然科学家们已证实凝结物能执行无数任务,但这些特殊液滴是否在染色质重塑中起任何作用,它们的特定氨基酸序列是否具有特定功能,都是未知的。
这些作者研究了 ARID1A/B IDR 的不同突变对 cBAF 蛋白复合物形成凝结物和招募基因表达所需的搭档蛋白的能力的影响。他们探究的一些突变与癌症或神经发育障碍有关。这些研究结果让人们深入了解了这些突变如何导致细胞过程出错,并为制定新的治疗策略奠定了基础。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


