《细胞研究》:首次发现肝癌“护城河”!复旦附属中山医院团队在肝癌周围发现了500微米宽的侵袭区,存在强烈免疫抑制,会促进癌症进展
来源:奇点糕 2023-07-12 15:48
这个研究表明,肝癌细胞通过分泌CXCL6,导致周围癌旁组织的肝细胞分泌SAAs,招募巨噬细胞围绕在肿瘤周围,并将其往M2型极化,给肿瘤打造了一个宽度为500微米且高度免疫抑制的“护城河”,帮助肝癌的进
肝癌,对于中国人来说是一个沉重的负担。
据世卫组织去年发布的全球癌症统计报告(GLOBOCAN),中国每年新发肝癌超过41万例,因肝癌死亡超过39万例,分别占全球的45%和47%[1]。更触目惊心的是,我国肝癌患者的5年生存率只有12.1%[2]。
肝癌为何如何凶险难治?近日,由复旦大学附属中山医院的周俭、陈奥、杨欣荣和刘石平领衔的研究团队,在著名期刊《细胞研究》上发表了一项重磅研究成果[3],在一定程度上揭开了肝癌难治之迷。
他们基于高分辨率的测序技术,首次在肝癌组织的周围发现了一层宽约500微米、横跨肝癌和癌旁组织的“护城河”。这个区域存在强烈的免疫抑制和代谢重编程,而且里面还存在一种分泌血清淀粉样蛋白A1和A2(SAAs)的受损肝细胞亚型。
值得一提的是,“护城河”中受损的肝细胞过度表达和分泌SAAs,会导致巨噬细胞的招募和M2极化,进一步促进局部免疫抑制,加速肝癌进展。临床回顾性队列研究也证实了上述发现。

论文首页截图
为了加深对肝癌的认知,研究人员将纳米级分辨率的空间转录组(Stereo-seq)和单细胞RNA测序(scRNA-seq)技术相结合,深入研究了来自于21名原发性肝癌患者的53份样本:肿瘤组织(T,12份)、肿瘤边缘区域(M,21份)、癌旁组织(P,10份)以及正常或转移的淋巴结(LN,10份)。他们还将这些数据整合,构建了原发性肝癌四种不同组织的单细胞和空间转录图谱。
基于上述数据,研究人员注意到,四个区域(T、M、P和LN)的细胞组成和空间分布具有高度异质性,除了癌细胞和肝细胞外,T/NK细胞、B细胞和成纤维细胞是最丰富的细胞。根据病理学家的分析结果,研究人员将肿瘤边缘区域(M)分成了两部分,一部分靠近肿瘤命名为M-T,一部分靠近癌旁组织命名为M-P。
进一步的研究发现,与其他区域相比,在肿瘤中观察到更多的内皮细胞和浆细胞,而成纤维细胞和巨噬细胞往往富集在M-T而不是肿瘤组织中,B细胞在LN中最为丰富。与癌旁组织组织相比,M-P聚集了更多的成纤维细胞。
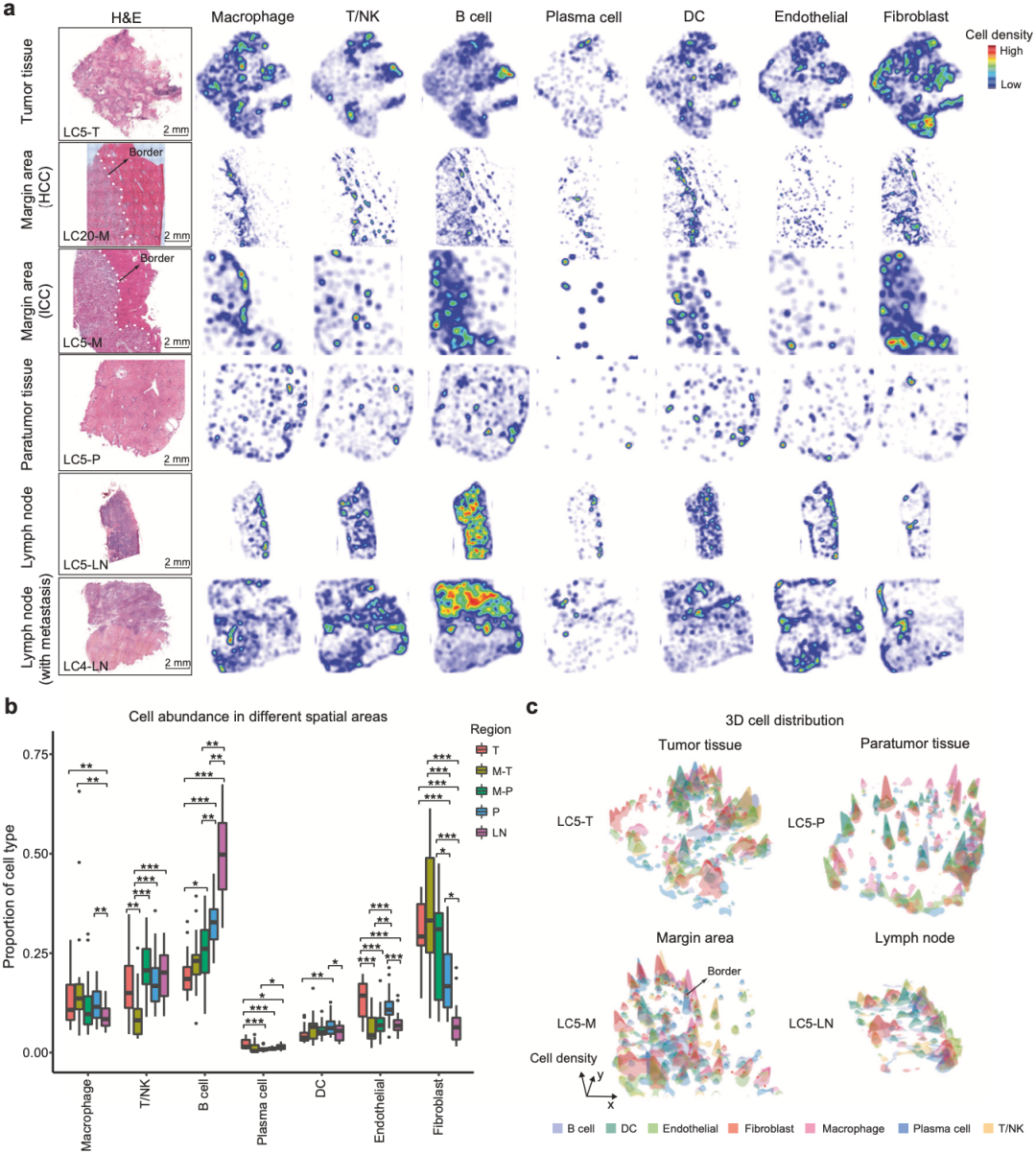
不同区域免疫细胞的分布
研究人员在对肿瘤边缘区域做了更细致的分析后发现,免疫细胞在离肿瘤一侧最接近边界的第一层(-250µm至0µm)内显著富集,免疫细胞在所有细胞中的占比达到30%以上。与癌旁那一侧的边界(M-P)相比,巨噬细胞、DCs、T/NK细胞和B细胞在M-T最靠近边界的区域含量更丰富。
他们还发现,在边界的肿瘤那一侧(M-T),从距离边界由远到近的地方,巨噬细胞、DCs、T/NK细胞和B细胞的比例逐渐增加。其中,巨噬细胞在距离边界最近的那一层(-250µm至0µm)含量最高,达到了8.6%,是距离边界最远那一层(-750µm至-500µm)的两倍多(3.9%)。验证队列的数据也证实了这一结论。
此外,研究人员还注意到,在边界的肿瘤那侧,离边界越近的地方巨噬细胞中发挥免疫抑制作用的M2型巨噬细胞占比越大,在离边界最近的那一层,M2巨噬细胞的占比达到了三分之二以上。如果从T细胞的角度来看的话,他们也发现离边界越近的地方耗竭T细胞占所有细胞的比越高,从最远第三层的0.09%飙升到最近第一层的0.54%。不难看出,越往边界靠近,免疫抑制作用越强,T细胞耗竭程度越重。
以上研究结果表明,在边界的肿瘤侧有个宽度约为250微米的免疫抑制的微环境。
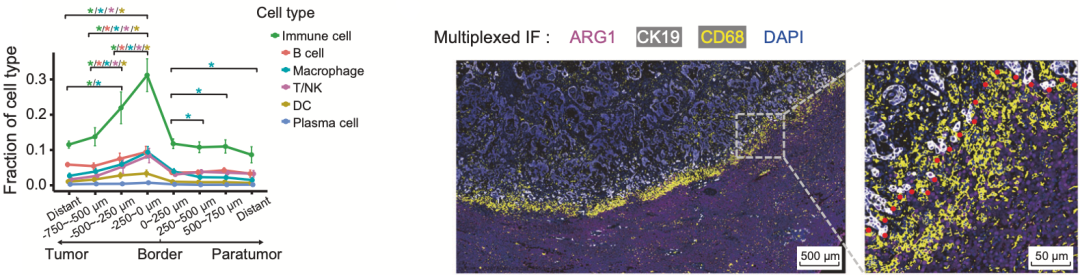
肿瘤侧有个宽度约为250微米的免疫抑制的微环境
除了免疫抑制微环境之外,研究人员还注意到,在边界的肿瘤侧,靠近边界的肿瘤细胞可以通过上调脂质代谢积极启动代谢重编程,以获得额外的能量来源,这对肿瘤侵袭性至关重要。此外,在边界的癌旁侧,与凋亡、血管生成、增殖能力、缺氧和糖酵解有关的途径,在距离边界最近的那一层(0-250微米)的细胞中显著富集,这意味着在这个区域有严重受损的肝细胞富集。
研究人员基于以上数据,在肝癌肿瘤组织的周围确定了一个独特的侵袭区——以肿瘤边界为中心的双侧各250微米宽的区域,这也就是我们在文章开头提到的那个500微米宽的“护城河”。这个侵袭区的特点是强烈的免疫抑制微环境,脂肪酸代谢的能量供应增强,肿瘤细胞的上皮-间质转化(EMT)能力增加,以及存在严重受损的肝细胞。
在接下来的研究中,他们在边界的癌旁组织侧第一层(0-250微米)发现了受损的肝细胞亚型Hep1细胞。从机制上讲,肝脏肿瘤细胞分泌的CXCL6会穿过侵袭区,激活Hep1细胞的JAK-STAT3途径,进而诱导SAAs的过度表达;而SAAs的分泌就可以招募大量的巨噬细胞进入肝癌周围的“护城河”,并促进巨噬细胞往促癌的M2型极化。
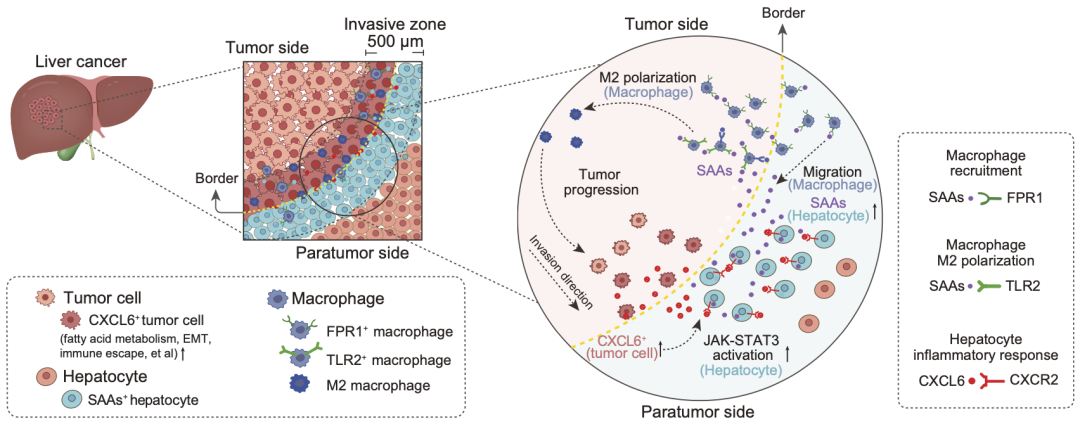
机制示意图
在研究的最后,研究人员探索了SAAs阳性肝细胞亚型与肿瘤进展之间的关系。
在肝癌患者的回顾性队列分析中,他们发现侵袭区SAAs的高表达与患者的预后较差有关。而小鼠模型实验则表明,敲除编码SAAs的基因,可以显著抑制体内原发性和继发性肝肿瘤的生长,而且肿瘤周围侵袭区的巨噬细胞的招募和M2极化都减少了。
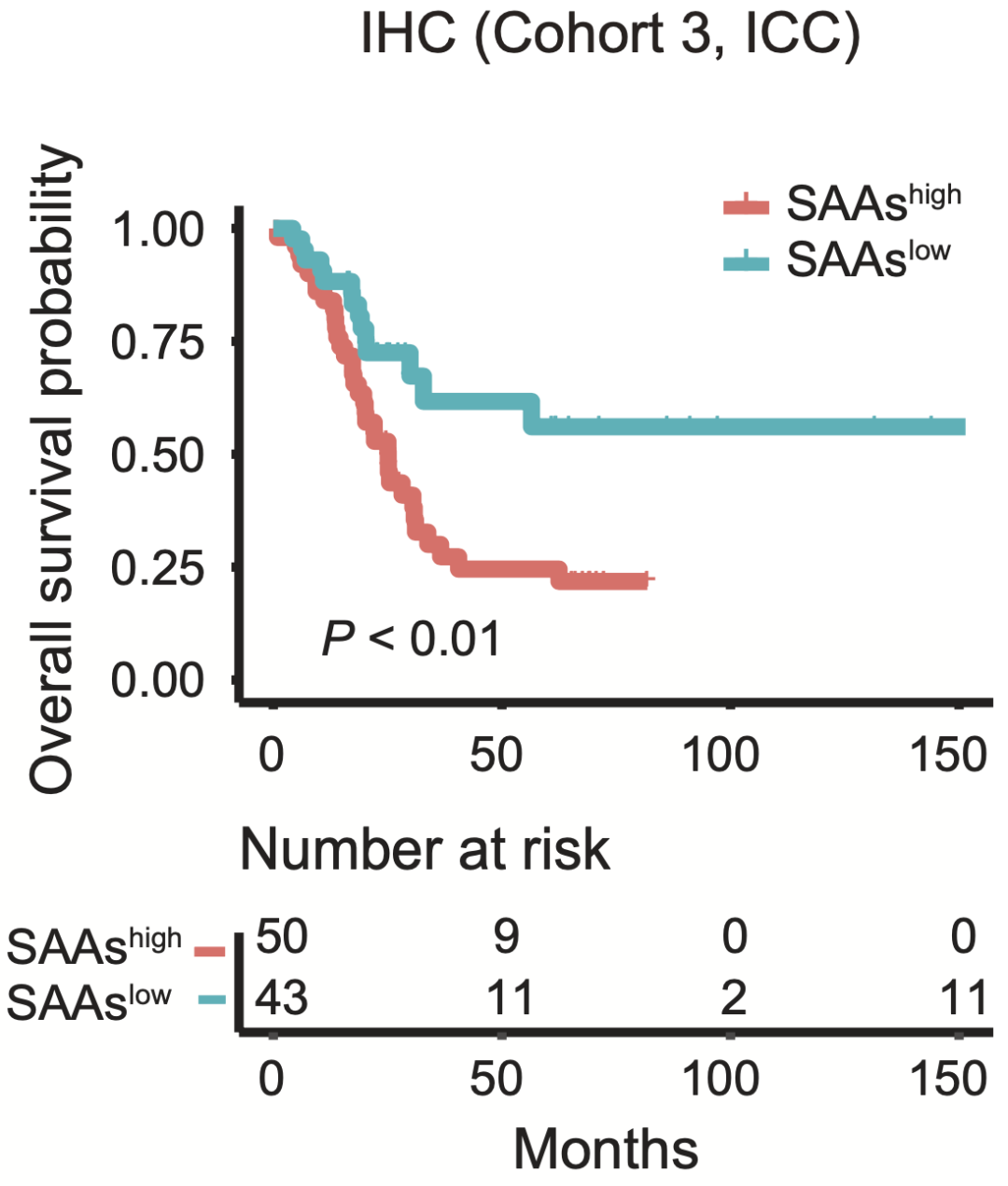
SAAs表达水平与患者OS的关系
总的来说,这个研究表明,肝癌细胞通过分泌CXCL6,导致周围癌旁组织的肝细胞分泌SAAs,招募巨噬细胞围绕在肿瘤周围,并将其往M2型极化,给肿瘤打造了一个宽度为500微米且高度免疫抑制的“护城河”,帮助肝癌的进展。
据了解,这也是科学家首次在肝癌肿瘤组织周围发现这么一个侵袭区,这对于我们理解肝癌微环境,寻找更有效的治疗方案有一定的指导意义。此外,这个研究中发现的SAAs阳性肝细胞,还能成为预测肝癌预后的标志物,这对于患者的精准治疗也有极大的价值。
参考文献:
[1].Rumgay H, Arnold M, Ferlay J, et al. Global burden of primary liver cancer in 2020 and predictions to 2040. J Hepatol. 2022;77(6):1598-1606. doi:10.1016/j.jhep.2022.08.021
[2].Zeng H, Chen W, Zheng R, et al. Changing cancer survival in China during 2003-15: a pooled analysis of 17 population-based cancer registries. Lancet Glob Health. 2018;6(5):e555-e567. doi:10.1016/S2214-109X(18)30127-X
[3].Wu L, Yan J, Bai Y, et al. An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression. Cell Res. 2023;10.1038/s41422-023-00831-1. doi:10.1038/s41422-023-00831-1
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


