华人教授创办,基于新型递送平台瞄准神经肌肉疾病,多条管线即将申请IND
来源:生辉 2023-06-12 09:17
肽、蛋白质和核酸等生物分子通常不能通过被动扩散穿过细胞膜。然而,细胞穿透肽 (CPP)、细菌蛋白毒素、某些真核蛋白、病毒和许多合成药物递送载体已被证明能够以不同的效率进入真核细胞的胞质溶胶。
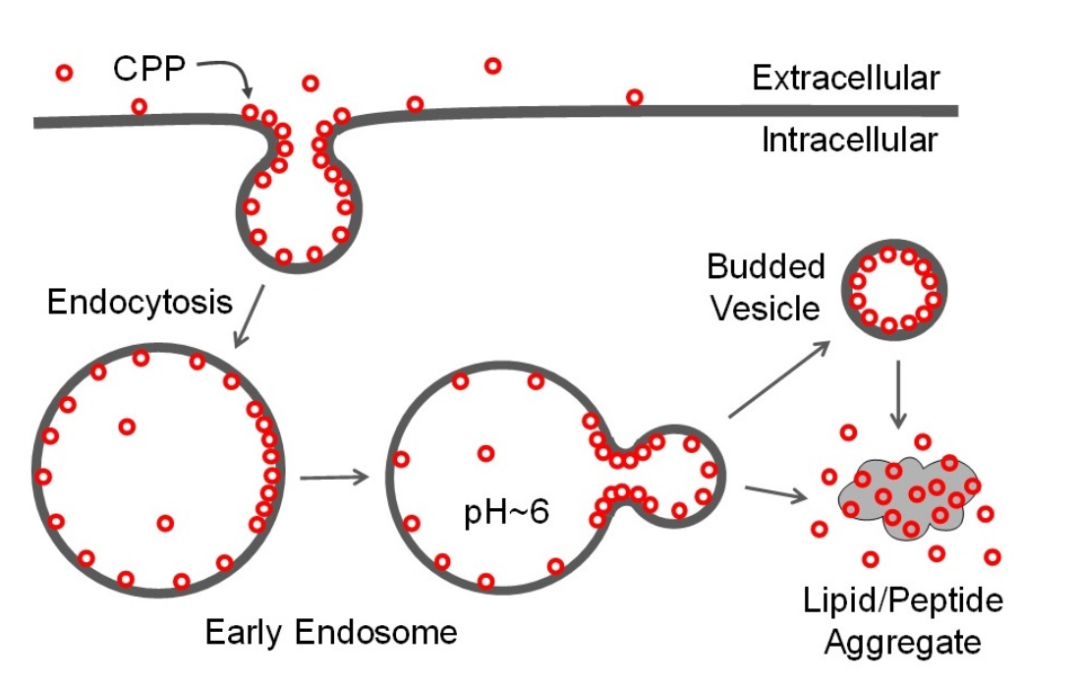
肽、蛋白质和核酸等生物分子通常不能通过被动扩散穿过细胞膜。然而,细胞穿透肽 (CPP)、细菌蛋白毒素、某些真核蛋白、病毒和许多合成药物递送载体已被证明能够以不同的效率进入真核细胞的胞质溶胶。它们通常通过一种或多种内吞机制进入细胞。但如何穿过内体膜到达胞质溶胶(即内体逃逸)一直是个谜。
(来源:ACS Chem)
2020 年,俄亥俄州立大学化学与生物化学系教授 Dehua Pei(裴德华)及团队发文论述了 CPP 将膜不可渗透的分子(核酸、蛋白质等)转运到细胞的胞质溶胶中的机制,尤其是它们如何在胞吞摄取后从核内体逃逸到胞质溶胶中,这有助于设计可穿过细胞膜的生物制剂作为一类新的药物,靶向不可成药的蛋白质。裴德华本科毕业于武汉大学,曾师从基因密码子扩展技术的开创者 Peter Schultz 教授。
如今,基于此研究成立的公司 Entrada Therapeutics(纳斯达克股票代码:TRDA)已在纳斯达克上市,目前该公司拥有多条管线,且多个项目即将申请 IND。
华人学者创办,斯坦福教授加盟
过去十年,裴德华及其团队发现了一个小的两亲性环状肽家族——细胞穿透肽(CPP),其具有出色的细胞溶质进入效率(高达 120%)、蛋白水解稳定性、生物利用度和广泛的生物分布。
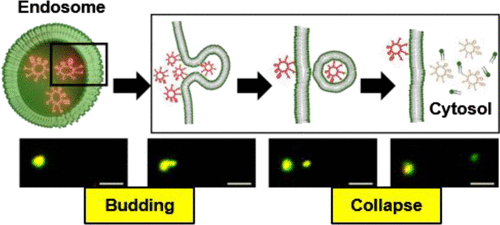
CPP 的出现绕过了此前的难题:即大多数治疗药物在被递送到溶酶体之前就被清除了。机理研究表明,CPP 直接与质膜磷脂结合,通过内吞作用进入细胞,随后通过一种新的膜易位机制从核内体逃逸到细胞质中,称之为“囊泡出芽和塌陷(VBC )”的机制。
▲图 | CPP 进入细胞和内体逃逸的机制(来源:Pei Group)
裴德华团队不仅证明了细菌毒素也通过 VBC 机制从内体中逃逸;还表明,环状 CPP 可用于有效地将所有主要药物形式(包括小分子、肽、蛋白质、核酸和蛋白质/核酸复合物)递送到哺乳动物细胞的胞质中。
基于上述研究,Entrada Therapeutics 于 2016 年落地,其以西班牙语中的“进入”一词命名,由裴德华与其博士后 Leo Qian 共同创立。后者现为 Entrada 的联合创始人兼发现与研究副总裁,Leo Qian 本科毕业于华东师范大学,后在俄亥俄州立大学取得博士学位。
2018 年,Entrada 在由 5AM Ventures 和 MPM Capital 以及 Roche Venture Fund、MRL Ventures Fund (MRLV) 和 Agent Capital 共同领投的 A 系列融资中筹集了 5900 万美元;2021 年 3 月,该公司完成1.16 亿美元的 B 轮融资;同年底,Entrada 在纳斯达克上市,目前拥有约 130 名员工。

▲图 | 裴德华(右)携 Entrada 在 2019 年大学创新与创业展示会上亮相(来源:OSU.EDU)
此外,来自斯坦福大学的 Peter Kim 教授也是该公司的董事会成员。他以病毒膜融合研究而闻名。上世纪九十年代初就阐释了流感病毒入侵人体细胞过程中发生膜融合的机制,并提出了“Spring-Loaded”模型,而这一模型提出的时候,流感 HA 蛋白融合后的结构还没有解析。此外,他设计了新的化合物来阻止艾滋病毒的膜融合,从而防止其感染细胞,并率先开发了基于类似原理的 HIV 疫苗。Kim 曾在默克任职 10 年,负责了 20 多种新药和疫苗的批准。
他与 Entrada 的首席科学家 Natarajan Sethuraman 博士合作,通过小鼠研究追踪 CPP,初步证明了其在肌肉中的渗透效率。
巧合的是,裴德华在一次演讲中展示新型肽的数据时,Peter Kim 正好在现场。当时,Peter Kim 在 5AM Ventures 担任顾问,其正在研究肽在医学中的应用。
内体逃逸率达 50%,多条管线即将申请 IND
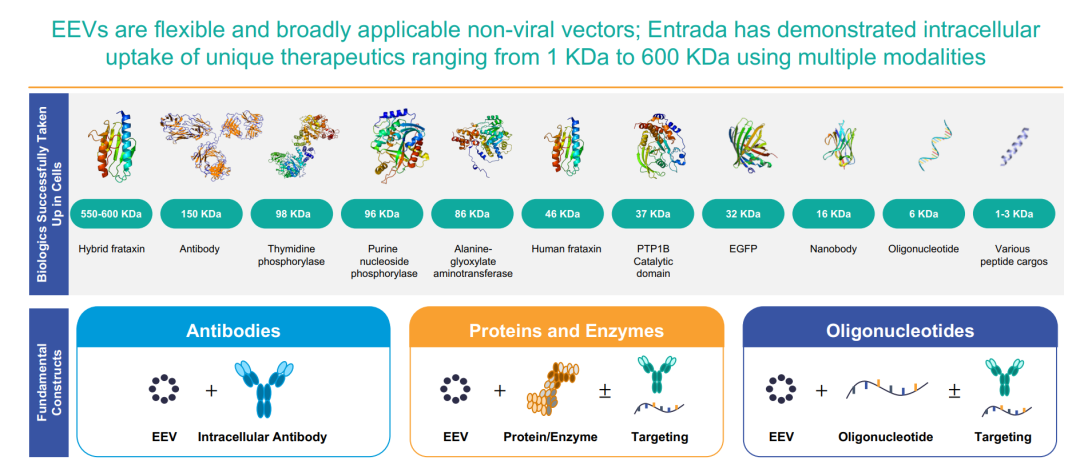
基于 CPP,Entrada 建立了内体逃逸载体平台(EEVTM),旨在解决治疗性药物递送到细胞内面临的基本问题:进入细胞,以及避免被细胞清除。也就是促进内体逃逸,实现更大效率的靶向。
CPP 的环状结构可以延长半衰期并提高稳定性;其与磷脂结合的特性能够实现对所有细胞的广泛分布;独特的化学作用也可以改善摄取和体内逃逸。
EEVTM 平台最大的特点是内体逃逸率达到了 50%,且可以递送寡核苷酸、抗体,以及酶等。相较传统生物疗法的内体逃逸率仅为 1-2%。
此外,由于 EEV 是模块化的,它们可以结合靶向序列,例如核靶向序列,以实现亚细胞靶向分辨率,并且可用于治疗多种疾病。据首席执行官 Dipal Doshi 透露,Entrada 正在设计一个线粒体靶向序列,针对一种线粒体疾病。
(来源:Entrada)
官网显示,该平台可针对神经肌肉疾病、免疫性疾病、眼部疾病,以及代谢疾病等。其中,Entrada 重点关注的疾病是杜氏肌营养不良症 (DMD) 和强直性肌营养不良症 1 型 (DM1) 。
DM1 是由 DM 蛋白激酶 (DMPK) 基因的 3'-非翻译区 (UTR) 突变引起的,该基因包含一个大的、扩展的三核苷酸 (CTG) 重复序列。与通常的 5-35 个三联体不同,突变的 DMPK 等位基因可以有多达数千个。因此,在 DM1 中,出现了两个治疗阵营:一个专注于降低 DMPK,而另一个则采用更具体、个性化的方法来防止三联体重复。
2022 年 12 月, Entrada 与 Vertex Pharmaceuticals 达成合作,共同开发 DM1 疗法。为此, Entrada 收到了 2.24 亿美元的预付款和 2600 万美元的股权投资,以及高达 4.85 亿美元的里程碑付款。双方于今年 2 月正式启动为期 4 年的合作,共同开发针对 DM1 的 ENTR-701 疗法,Entrada 负责推进与 ENTR-701相关的研究活动及其他与 DM1 相关的研究;Vertex 将负责 ENTR-701 的全球开发、制造和商业化,以及 Entrada 的 DM1 研究工作产生的任何其他项目。
临床前研究的数据表明,ENTR-701 将各种肌肉群中与疾病相关的生物标志物得到了纠正。Entrada 预计将于今年向 FDA 提交 ENTR-701的 IND 申请。

▲图 | Entrada 部分管线(来源:公司官网)
另外,Entrada 现布局了 4 条 DMD 管线,分别针对 44、45、50、51 外显子跳跃。据公开数据显示,大约80%的患者有核外显子跳变的突变,约40% 的 DMD 患者存在外显子 44、45、51 和 53 的跳变。
但 FDA 于早些时候叫停了 DMD 候选药物 ENTR-601-44 的临床试验申请,目前正在解决中。临床前数据证明,ENTR-601-44 在非人类灵长类动物中的反应持久性长达 12 周;另一候选药物 ENTR-601-45 预计将于 2024 年下半年提交 IND 申请。
针对 DMD,Entrada 将寡核苷酸与 EEV 结合使用,Sarepta Therapeutics 的基因治疗方式则仅依赖于寡核苷酸。根据 Doshi 的说法,Entrada 在 DMD 上收集的数据是“天文数字”。据路透社日前报道,FDA 已推迟了 Sarepta Therapeutics 加速批准决定,且可能将其疗法限制在较小患者群体内。
值得注意的是,在美国证券交易委员会的一份文件中,Entrada 表示开始围绕基因编辑开展一些工作,且取得了一些初步的结果。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


