Molecular Cancer : YAP调控一种谱系特异性NeuRegin1通路驱动的对RAF激酶抑制剂的适应性抵抗
来源:生物谷原创 2022-12-26 11:23
由于原发或获得性耐药的发展,对大多数癌症类型的靶向治疗的完全反应仍然难以捉摸。
由于原发或获得性耐药的发展,对大多数癌症类型的靶向治疗的完全反应仍然难以捉摸。在BRAFV600E驱动的癌症的背景下,黑色素瘤、结直肠或甲状腺肿瘤中细胞对RAF激酶抑制剂的自主内在抵抗通常是由于不同的谱系依赖机制,这些机制最终聚集在ERK的重新激活上。
河马途径的失活促进了YAP的核转位,使转录程序得以执行,从而诱导组织生长。河马中间体的基因损伤只能识别少数YAP非法激活的癌症。YAP与靶向治疗的耐药性有关,但YAP可能影响对MAPK抑制剂的适应性耐药性的机制尚不清楚。

图片来源:https://doi.org/10.1186/s12943‑022‑01676‑9
近日,来自纪念斯隆凯特琳癌症中心的研究者们在Molecular Cancer杂志上发表了题为“Yap governs a lineage‑specific neuregulin1 pathway‑driven adaptive resistance to RAF kinase inhibitors”的文章,该研究揭示了 YAP调控一种谱系特异性NeuRegin1通路驱动的对RAF激酶抑制剂的适应性抵抗。
河马途径的失活促进了YAP的核转位,使转录程序得以执行,从而诱导组织生长。河马中间体的基因损伤只能识别少数YAP非法激活的癌症。YAP与靶向治疗的耐药性有关,但YAP可能影响对MAPK抑制剂的适应性耐药性的机制尚不清楚。
在本研究中,研究者用免疫荧光和细胞裂解产物分级的方法筛选了52个甲状腺癌细胞系中不合法的核YAP定位。研究者设计了一种强力霉素(DOX)诱导的甲状腺特异性小鼠模型,单独表达核YAPS127A,或联合内源性表达HrasG12V或BRAFV600E。
研究者还建立了表达DOX诱导的sh-miR-E-YAP和/或YAPS127A的细胞系。研究者使用细胞存活率、侵袭力测定、免疫荧光、Western blotting、qRT-PCRS、流式细胞术和细胞分选、高通量批量RNA测序和体内肿瘤发生来研究YAP依赖和BRAF突变细胞对维莫拉非尼的反应。
研究者发现,在高密度(NU-YAP)培养下,27/52甲状腺癌细胞系存在YAP核定位的结构性异常,这使得它们的存活率、侵袭力和对YAP-tead复合体抑制剂维替普芬的敏感性依赖于YAP,而汇合驱动的YAP核排除(CyT-YAP)细胞则没有。用RAF激酶抑制剂处理BRAF突变的甲状腺癌细胞,可导致YAP核移位并激活其转录产物。
BRAF突变的甲状腺细胞对维莫拉非尼的耐药性是由YAP依赖的NRG1、HER2和HER3激活驱动的,所有受测的人和小鼠同基因甲状腺细胞系中的这种激活通过沉默YAP而被取消,并被PAN-HER激酶抑制剂缓解。YAP激活可诱导BRAF黑色素瘤细胞发生类似的变化,但不能诱导结直肠细胞。
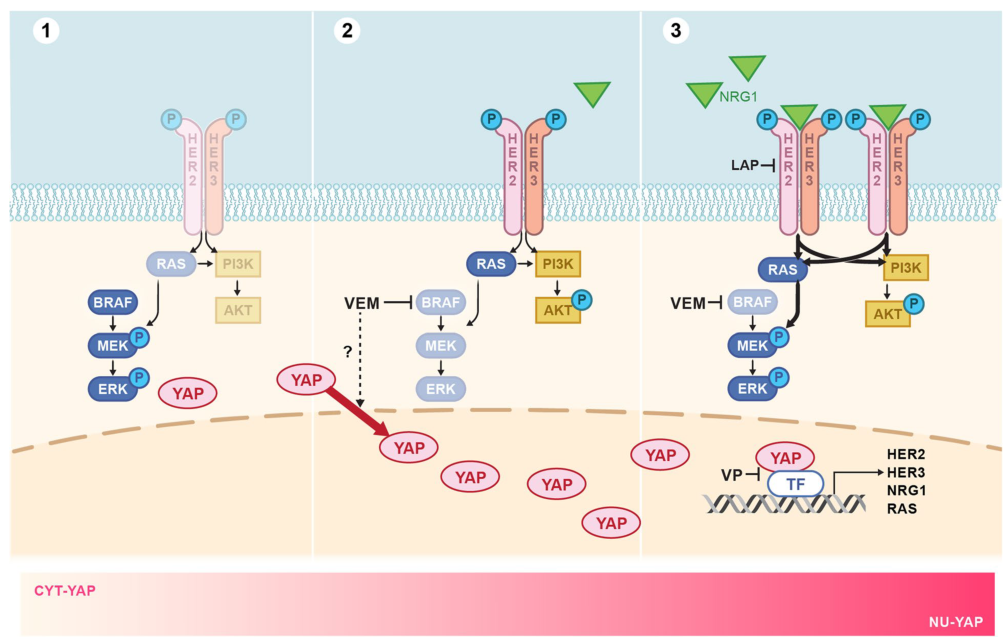
YAP/TEAD活性作为变阻器控制MAPK抑制后RTK信号的适应性变化的幅度
图片来源:https://doi.org/10.1186/s12943‑022‑01676‑9
总之,具有YAP转录活性结构性激活的BRAF突变甲状腺癌细胞对RAF激酶抑制剂具有内在的抵抗力,部分原因是NRG1信号通路上游成分的表达增加。此外,RAF激酶抑制剂诱导YAP的转录输出,这可能调控或加强细胞如何适应肿瘤驱动因素的抑制。目前正在进行的开发有效的YAP/TEAD抑制剂的广泛努力应该很快就会使这些概念在临床前模型和临床试验中得到进一步测试。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


