Science:为人类细胞优化的桥接重组酶使得大规模的可编程DNA重排成为可能
来源:生物谷原创 2025-09-29 11:41
在《科学》杂志上发表的一篇论文中,研究团队展示了如何将桥接重组酶(Bridge recombinase)技术应用于人类细胞。
数十年来,基因编辑科学一直局限于对人类DNA进行小型精确编辑,类似于纠正遗传密码中的拼写错误。Arc研究所的研究人员正在通过一种通用基因编辑系统改变这一范式,该系统允许对完整的基因组"段落"进行剪切和粘贴,重新排列整个"章节",甚至重构基因组"手稿"的整个"篇章"。

在《科学》杂志上发表的一篇论文中,研究团队展示了如何将桥接重组酶(Bridge recombinase)技术应用于人类细胞。这一进展使科学家能够操控大的基因组区域(测试长度可达100万个碱基对),通过插入新基因、删除整个基因簇或倒置调控序列来实现。
"桥接重组酶可以通过为每个患者群体提供一种多功能药物,而非数千种个体化治疗,来改变我们创造基因疗法的方式,"该研究的资深作者、Arc研究所核心研究员、加州大学伯克利分校生物工程系教员Patrick Hsu表示。"凭借移动和重塑整个遗传区域的能力,我们可以在进化运作的尺度上设计生物学,并将这些能力应用于解决复杂疾病。"
桥接重组酶是从劫持细菌基因组以维持自身生存的寄生性可移动遗传元件中发现的。同一团队于2024年在《自然》杂志上报告称,这些元件编码了一类新型结构化向导RNA(他们将其命名为"桥接RNA")和一种能重新排列DNA的重组酶。
Hsu及其同事通过重新编程桥接RNA以靶向新的DNA序列,重新利用了这一自然系统,为他们称之为桥接重组酶的新型精确基因编辑工具奠定了基础。
"我们这篇新论文的不同之处在于,我们不仅能够展示向人类基因组中的插入,而且还以可编程的方式相当高效地展示了基因组序列的切除和倒置,"该研究的第一作者、Hsu实验室的Arc科学家Nicholas Perry说,他也是在加州大学伯克利分校攻读博士期间进行这项研究的。"该平台的应用尤其令人兴奋,并且可以广泛适用于多种科学项目。"
研究团队从分离自细菌的72种不同的自然桥接重组酶系统开始,发现其中约25% 在人类细胞中显示出一定的活性,但大多数活性几乎检测不到。只有一个名为ISCro4的系统显示出足够可测量的活性,可以进行进一步优化。
随后,他们系统地改进了蛋白质及其RNA向导组件,测试了数千种变体,最终在人类基因组中实现了20% 的DNA插入效率和82% 的命中预期靶点的特异性。
虽然CRISPR使用单个向导RNA来靶向一个DNA位点,但桥接RNA的独特之处在于它们可以通过不同的结合环同时识别两个不同的DNA靶点。这种双重识别使系统能够执行协调的重排,例如将遥远的染色体区域拉近以切除遗传物质,或将现有序列翻转成反向取向。该系统充当分子支架,将两个DNA位点固定在一起,同时重组酶执行重排反应。
作为概念验证,研究人员创建了人工DNA构建体,其中包含与导致弗里德赖希共济失调患者进行性神经肌肉衰退相同的毒性重复序列。虽然健康个体携带少于10次连续的三字母DNA序列重复,但患有此疾病的人可能携带多达1700次重复,这会干扰正常的基因功能。工程化的ISCro4成功地从人工构建体中移除了这些重复序列,在某些情况下消除了超过80% 的扩展序列。
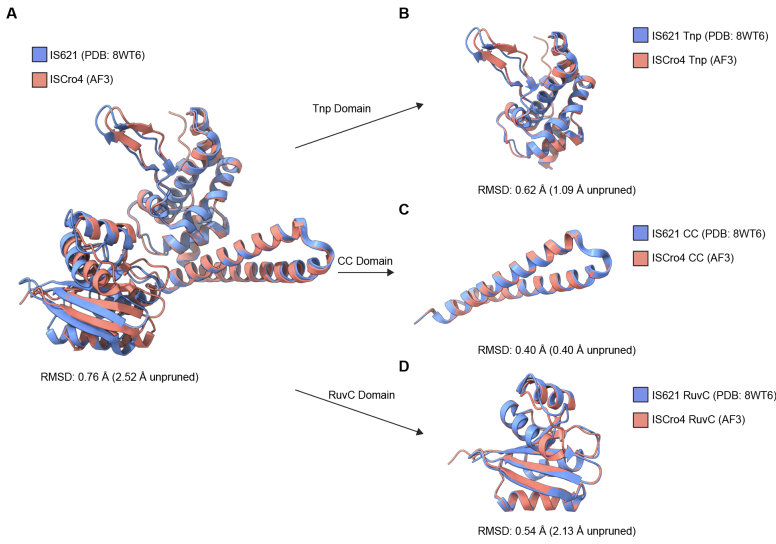
"由于疾病严重程度与重复长度相关,任何程度的切除,无论是否达到完全健康的基因型,都有可能改善患者症状,"Perry说。"桥接重组酶可适用于任何由(序列)扩展引起的遗传性疾病,并且由于我们只需要递送RNA分子而非蛋白质或DNA就能使其在人类细胞内工作,该方法实施和扩展起来可能简单得多。"
该团队还证明,桥接重组酶可以通过成功移除BCL11A增强子(这是FDA批准的镰状细胞贫血疗法中干扰的同一靶点)来复制现有的治疗方法。而且,由于桥接重组酶能够移动大量DNA,该技术还有助于模拟与癌症相关的大规模基因组重排。
研究人员目前正在努力扩展该平台的能力,包括在临床相关的免疫细胞和干细胞中测试桥接重组酶、开发治疗性递送方法,以及设计能够处理超过100万个碱基对DNA片段的变体。他们还计划探索在植物遗传学和合成生物学中的应用。(生物谷Bioon.com)
参考文献:
Nicholas T. Perry et al, Megabase-scale human genome rearrangement with programmable bridge recombinases, Science (2025). DOI: 10.1126/science.adz0276.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


