Nature子刊:一种关键蛋白复合物驱动阿尔茨海默病中的神经细胞死亡
来源:生物谷原创 2025-08-31 11:24
在小鼠模型实验中,他们成功利用神经保护分子FP802解离了这种致命蛋白复合物。FP802通过与TRPM4和NMDA受体相互作用的"TwinF"接触面结合,阻断这两种蛋白的物理相互作用。
在一项新的研究中,德国海德堡大学神经生物学家Hilmar Bading教授领导的研究团队发现了一个显著促进阿尔茨海默病进展的分子机制,该研究发表于《分子精神病学》期刊。

通过与中国山东大学研究人员的联合实验,团队利用阿尔茨海默病小鼠模型证实:一种神经毒性蛋白复合物会导致大脑神经细胞死亡并引发认知能力下降。他们表示,这一发现为开发有效疗法开辟了新视角。
这种已知的蛋白复合物由NMDA受体和TRPM4离子通道组成。参与神经细胞信号传递的NMDA受体存在于细胞表面,既分布于突触也存在于神经细胞接触点之外,可被神经递质谷氨酸激活。
Bading教授解释:"虽然大脑中突触NMDA受体的激活对神经细胞存活和认知能力维持至关重要,但TRPM4却赋予突触外NMDA受体毒性特征。二者形成的'死亡复合物'会导致神经细胞损伤甚至死亡。"
这项研究显示,阿尔茨海默病小鼠体内的神经毒性NMDAR/TRPM4复合物水平远高于健康动物。通过使用新型化合物FP802(一种Bading团队此前发现的"TwinF界面抑制剂"),研究团队证实该复合物在认知能力下降进程中起关键作用。
在小鼠模型实验中,他们成功利用神经保护分子FP802解离了这种致命蛋白复合物。FP802通过与TRPM4和NMDA受体相互作用的"TwinF"接触面结合,阻断这两种蛋白的物理相互作用。
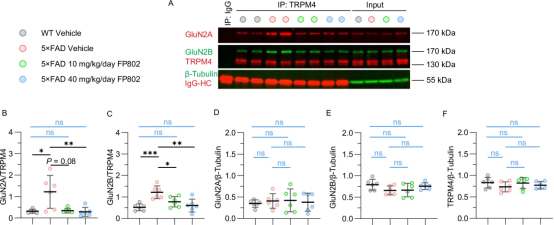
论文第一作者Jing Yan博士表示:"经FP802治疗的患病小鼠病情进展显著减缓。"研究团队观察到,阿尔茨海默病的典型细胞变化——包括突触损失、线粒体结构和功能损伤——仅有限发展或完全未出现。
学习记忆等认知能力基本保持完好,此外大脑中β-淀粉样蛋白沉积的形成也显著减少。Bading教授指出:"该策略与既往治疗方法存在根本区别——我们不是针对淀粉样蛋白的形成或清除,而是阻断下游细胞机制(NMDAR/TRPM4复合物),这种机制不仅导致神经细胞死亡,还会通过疾病促进反馈循环加剧淀粉样沉积。"
此前研究已证实TwinF界面抑制剂FP802在肌萎缩侧索硬化(ALS)疾病模型中同样具有神经保护作用。研究人员认为,这种新型抑制剂可能成为广泛适用的药理学原理,可减缓甚至阻止阿尔茨海默病和ALS等神经退行性疾病的进展。
但Bading教授强调临床应用仍任重道远:"临床前研究结果令人鼓舞,但要实现人体应用仍需完成全面的药理学开发、毒理学实验和临床研究。"未来几年将与FundaMental Pharma密切合作,进一步优化神经保护分子FP802。(生物谷Bioon.com)
参考文献:
Jing Yan et al, The NMDAR/TRPM4 death complex is a major promoter of disease progression in the 5xFAD mouse model of Alzheimer's disease, Molecular Psychiatry (2025). DOI: 10.1038/s41380-025-03143-5.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


