高脂饮食会“逼疯”肝细胞!Cell:高脂肪饮食使肝细胞逆转成干细胞样状态,肝癌风险飙升
来源:生物谷原创 2026-01-01 09:39
研究团队给小鼠喂食高脂饮食(60% 热量来自脂肪),并在 6 个月、12 个月、15 个月等关键时间点,通过单细胞 RNA 测序、表观遗传分析等技术,监测肝细胞的基因表达和形态变化。
高脂饮食早已被证实是诱发肝癌的关键风险因素,而麻省理工学院团队在《Cell》发表的重磅研究,首次揭开了背后的核心机制:长期高脂饮食会迫使成熟肝细胞 “逆生长” 为干细胞样的不成熟状态,这种为了在代谢应激中存活的 “自保行为”,恰恰为日后癌变埋下了致命隐患,同时也锁定了多个可精准干预的药物靶点。

作为全球发病率极高的代谢相关肝病,代谢相关脂肪性肝病(MASLD)已影响超过 33% 的全球人口,若持续进展会引发肝炎、纤维化,最终可能恶化为肝硬化和肝细胞癌(HCC)。过去,人们只知道高脂饮食会导致肝脏脂肪堆积和炎症,但肝细胞如何一步步走向癌变,始终是未解之谜。麻省理工学院 Alex K. Shalek 教授、Ömer Yilmaz 副教授与 Wolfram Goessling 教授联合领导的团队,通过长期追踪高脂饮食小鼠的肝脏变化,终于破解了这一谜题。
研究团队给小鼠喂食高脂饮食(60% 热量来自脂肪),并在 6 个月、12 个月、15 个月等关键时间点,通过单细胞 RNA 测序、表观遗传分析等技术,监测肝细胞的基因表达和形态变化。
结果发现,高脂饮食带来的慢性代谢应激,会触发肝细胞启动一套 “生存权衡” 策略:为了抵御细胞凋亡、在恶劣环境中存活,肝细胞会主动开启抗凋亡、促增殖的基因(如 Bcl2l1、Cdkn1a),同时关闭维持正常肝功能的核心基因(如代谢酶 Hmgcs2、尿素循环关键酶 Cps1、肝脏特异性转录因子 HNF4A)。
这种变化并非一蹴而就,部分基因如代谢酶的表达下降是渐进式的,但最终导致的结果是:成熟肝细胞逐渐丧失原有的代谢、解毒等功能,逆转为类似胎儿期肝细胞的不成熟状态,而这种去分化状态正是癌症发生的重要前兆。
更令人警惕的是,几乎所有长期食用高脂饮食的小鼠,在 15 个月后都自发患上了肝癌。研究人员解释,这些逆转为干细胞样状态的肝细胞,已经提前激活了癌细胞所需的关键基因,失去了成熟肝细胞的增殖抑制特性。一旦后续发生基因突变,它们会比正常肝细胞更快突破生长限制,加速癌变进程。“细胞为了当下存活,牺牲了组织的长期健康,这种看似合理的适应,最终让它们在癌变的道路上抢占了先机。” 论文共同第一作者 Constantine Tzouanas 说道。
为了验证这一发现的临床相关性,团队分析了人类 MASLD 患者的肝组织样本数据,从早期脂肪肝到肝硬化、肝癌的不同阶段,都观察到了与小鼠模型高度相似的模式:肝脏功能基因表达逐渐下降,而干细胞样特征基因(如 SOX4、Lgr5)表达持续升高。
更关键的是,通过这些基因表达模式,能精准预测患者的生存预后——那些促生存基因高表达、肝功能基因低表达的患者,肝癌发生后的存活时间显著缩短。这意味着,这种肝细胞的 “逆生长” 变化,不仅是癌变的预警信号,更是评估患者风险的重要生物标志物。
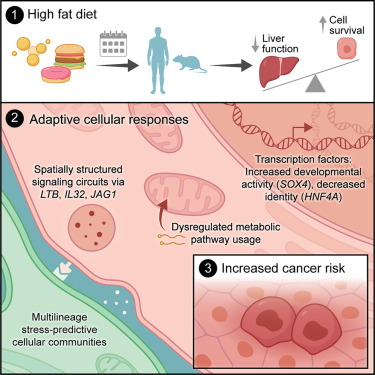
研究还锁定了驱动这一过程的核心调控因子,为治疗提供了明确方向。其中,转录因子 SOX4 是关键 “推手”,它原本仅在胎儿发育阶段活跃,却在高脂饮食的肝细胞中被异常激活,直接促进肝细胞去分化和增殖;而酮体生成关键酶 HMGCS2 的表达则持续下降,导致脂质代谢紊乱,进一步加剧细胞应激。值得振奋的是,针对这些靶点的干预已有明确进展:甲状腺激素受体(THRB)激动剂已获批用于治疗 MASH 相关纤维化,激活 HMGCS2 的药物正处于临床试验阶段,而 SOX4 也成为极具潜力的新型抗癌靶点。
此外,团队通过空间转录组学发现,肝细胞的 “逆生长” 并非孤立发生,而是受到周围微环境的调控。CD9+TREM2+瘢痕相关巨噬细胞、IGFBP1+PCK1+胆管细胞等形成的多细胞信号网络,会通过 LTB、JAG1、IL32 等信号分子,进一步强化肝细胞的应激适应和去分化,形成促癌的 “土壤”。这一发现提示,未来的治疗可能需要兼顾细胞内在调控和微环境干预,才能更彻底地阻断癌变路径。
虽然小鼠在一年内就出现了明显癌变,但研究人员估计,人类这一过程可能长达 20 年,期间饮食、饮酒、病毒感染等因素都会加速或延缓进程。目前,团队已计划进一步研究:通过调整饮食、使用 GLP-1 激动剂等减肥药物,是否能逆转肝细胞的去分化状态;同时,针对 SOX4、HMGCS2 等靶点的精准药物,也有望为高脂饮食爱好者、MASLD 患者等高危人群,提供预防肝癌的新方案。
“我们终于明确了高脂饮食诱发肝癌的分子链条,这些新发现的靶点和机制,为高风险人群的早期干预提供了切实可行的方向。”Alex K. Shalek 教授表示。这一研究不仅让人们对饮食与癌症的关联有了更深层的理解,更在实验室与临床之间架起了桥梁,未来通过针对性干预,或许能让肝细胞 “放弃自保、回归本职”,从源头降低肝癌风险。(生物谷Bioon.com)
参考文献:
Constantine N. Tzouanas et al, Hepatic adaptation to chronic metabolic stress primes tumorigenesis, Cell (2025). DOI: 10.1016/j.cell.2025.11.031.
版权声明
本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->





