Nature子刊:伍浩等人揭示线粒体功能障碍驱动T细胞耗竭
来源:生物世界 2023-11-16 10:36
总的来说,这些发现表明,线粒体功能障碍和HIF-1α介导的糖酵解重编程都有助于T细胞耗竭,而药理学抑制糖酵解重编程(使用2-DG抑制糖酵解)是一种可行的代谢干预策略,能够在慢性病毒感染和癌症免疫治疗期
近日,德国维尔茨堡大学的 Martin Vaeth 团队(伍浩博士为论文第一作者)在 Nature 子刊 Nature Communications 上发表了题为:Mitochondrial dysfunction promotes the transition of precursor to terminally exhausted T cells through HIF-1α-mediated glycolytic reprogramming 的研究论文。
该研究确定了T细胞耗竭过程受到“细胞的发电站”——线粒体的显著影响。该研究通过基因缺陷小鼠、单细胞转录组学和代谢组学分析,表明了线粒体功能障碍是启动T细胞耗竭的细胞内源性触发器。在分子水平上,线粒体功能障碍引起氧化还原应激,抑制缺氧诱导因子1α(HIF-1α)的蛋白酶体降解,并促进Tpex细胞向终末耗竭T细胞的转录和代谢重编程。这些发现表明,线粒体功能障碍和HIF-1α介导的糖酵解重编程都有助于T细胞耗竭,
这项发现也具有重要的临床意义,使用2-DG抑制糖酵解,能够在慢性病毒感染中和癌症免疫治疗期间分别维持T细胞和CAR-T细胞的干性、寿命和功能。

幼稚T细胞(Naive T Cell)以低速分解代谢为特征,主要通过线粒体呼吸和脂肪酸氧化(FAO)来产生ATP。为了满足增加的能量需求,活化T细胞重启其代谢机制,利用有氧糖酵解和氧化磷酸化(OXPHOS)产生ATP和生物合成。虽然代谢重编程控制T细胞激活和效应/记忆分化的多个方面,但代谢的调节及其对T细胞功能障碍的贡献尚未完全了解。
最近的研究表明,在慢性病毒感染和癌症中,线粒体功能障碍与体外T细胞耗竭相关,但这些变化是T细胞耗竭的原因还是结果,尚不清楚。
为了证明线粒体功能障碍是T细胞耗竭的实际原因,团队开发了一种新的遗传模型——它关闭了线粒体磷酸盐转运体(SLC25A3),使T细胞中的线粒体呼吸作用失效。此时T细胞被迫转向替代代谢途径——主要是有氧糖酵解,以满足细胞对ATP的需求。然而,这种代谢适应导致T细胞中活性氧(ROS)的产生增加。
该研究提供了遗传学证据,表明受损的线粒体呼吸不仅仅是T细胞功能障碍的结果,而是足以引起T细胞耗竭的转录、表型和功能特征。从机制上讲,线粒体功能障碍引起的氧化应激对抗缺氧诱导因子1α(HIF-1α)的蛋白酶体降解,这介导了Tpex细胞的糖酵解重编程,作为终末分化的初始步骤。这些研究结果还表明,线粒体呼吸是耗竭T细胞干性的前提条件,限制其糖酵解能力是维持慢性病毒感染和癌症期间T细胞功能的有前途的代谢策略。
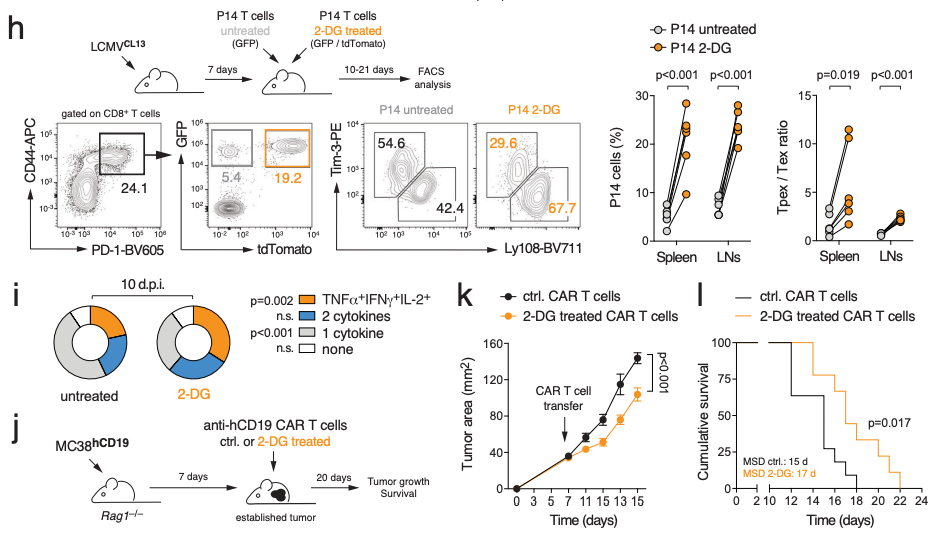
总的来说,这些发现表明,线粒体功能障碍和HIF-1α介导的糖酵解重编程都有助于T细胞耗竭,而药理学抑制糖酵解重编程(使用2-DG抑制糖酵解)是一种可行的代谢干预策略,能够在慢性病毒感染和癌症免疫治疗期间维持CAR-T细胞的干性、寿命和功能。
论文通讯作者 Martin Vaeth 解释道,这种依赖HIF-1α的T细胞耗竭控制在以前是未知的。它代表了线粒体呼吸和T细胞功能之间的一个关键调节通路,在T细胞耗竭的过程中充当着“代谢检查点”。展望未来,研究团队希望探索线粒体呼吸如何影响T细胞的表观遗传编程,以及T细胞代谢与局部组织微环境的相互作用。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


