Adv Sci 黑科技!体温触发的“修复凝胶”,终结肠道瘘管开腹之痛
来源:生物谷原创 2025-12-08 15:40
GNGP机械活性水凝胶可响应体温主动收缩,兼具抗菌、强粘附等优势,通过YAP介导的机械敏感性促进肠上皮细胞增殖,为肠道瘘管提供微创高效的修复方案。
消化道术后,肠道瘘管堪称一道“生死关”。这层肠道与周围组织的异常连通,不仅让营养吸收彻底“罢工”,更可能引发致命感染、败血症,让患者在术后还要直面高死亡率的威胁。传统治疗要么是创伤巨大的开腹手术,要么依赖纤维蛋白胶等密封材料,却始终摆脱不了黏膜修复难、细菌易滋生、愈合易复发的困境。
如今,Adv Sci发表的一项突破性研究,让这一局面迎来转机——一款能被体温“激活”的智能修复水凝胶GNGP,直接改写肠道瘘管的治疗格局,让微创修复成为可能。

GNGP水凝胶的研发遵循生物驱动设计理念,由甲基丙烯酸明胶(GelMA)、N-异丙基丙烯酰胺(Nipam)、没食子酸明胶(GGA)和聚赖氨酸(ε-PL)四种核心成分协同构成。抗菌肽ε-PL赋予其广谱抗菌能力,可精准抵御临床常见致病菌;Nipam的温敏相变特性与GelMA的刚度、明胶的低温物理交联相结合,实现了可注射性与体温响应收缩的完美协同;GGA通过仿生湿粘合技术强化组织粘附力,确保水凝胶在肠道蠕动中稳固附着;GelMA则精准调控降解速率,既为修复提供临时支架,又能顺利代谢不引发异物反应。
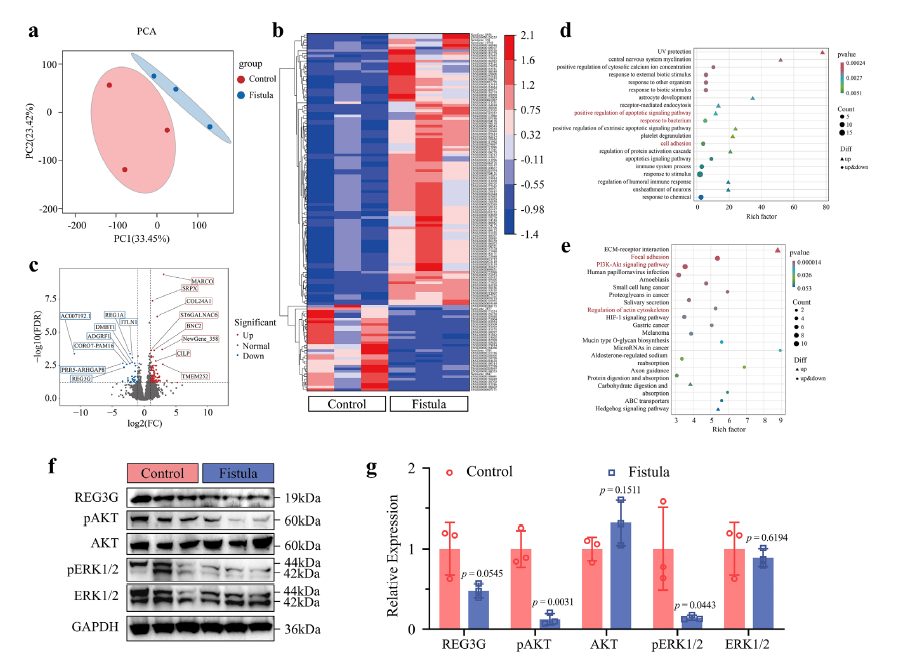
图1:临床肠道瘘管样本的RNA测序结果
性能测试中,这款“智能修复凝胶”展现出惊人的临床适配性。它在体温环境下能快速完成凝胶-溶胶相转变,经紫外线照射7秒内即可固化形成稳定粘附界面。其模量与肠、皮肤组织(1-10 kPa)高度匹配,为肠黏膜上皮细胞迁移和修复提供适宜的力学支撑。粘附强度测试显示,当GGA浓度达到4%时,水凝胶粘附力趋于稳定,且显著优于商用纤维蛋白胶;在37℃体温下,它会呈现反常溶胀行为,通过疏水作用力挤出内部液体,既主动缩小肠道缺损尺寸,又能形成保护粘液层,抵御肠液侵蚀。更值得关注的是,其破裂压力高达118.4±8.2 mmHg,远超纤维蛋白胶,足以耐受肠道运动和腔内压力,避免机械损伤导致的修复失败。
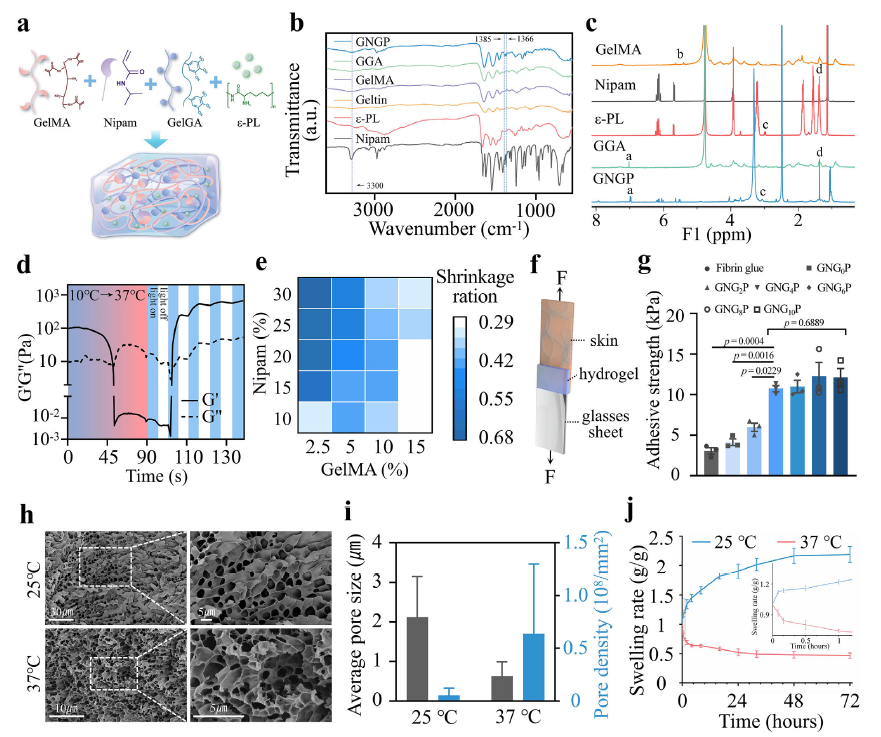
图2:GNGP机械活性水凝胶的合成与表征
生物安全性是临床应用的核心前提。降解实验数据显示,GNGP水凝胶在大鼠体内8周降解率可达95%,初期为肠上皮细胞迁移提供支架,后期逐步降解,不会引发明显异物炎症反应,对心脏、肝脏等重要器官无毒性影响。分解产生的Nipam单体浓度远低于细胞毒性剂量,直接接触的细胞未出现显著凋亡。细胞相容性实验中,水凝胶提取物培养大鼠成纤维细胞24、48小时后,细胞存活率均超过97%,与对照组无显著差异;抗菌实验证实,它对金黄色葡萄球菌、大肠杆菌、高毒肺炎克雷伯菌均有显著抑制作用,且抗菌效果随ε-PL浓度升高而增强,为感染防控提供双重保障。

图3:GNGP水凝胶的密封性能与机械活性
在兔肠道瘘管模型中,GNGP水凝胶的治疗效果堪称惊艳。治疗3天后,GNGP组肠黏膜缺损面积明显缩小,炎症反应显著减轻,胶原纤维沉积量大幅增加;治疗7天后,瘘管实现全层愈合,而对照组仍存在明显炎症浸润和组织缺损。免疫组化结果显示,GNGP组Ki67和增殖细胞核抗原(PCNA)表达显著升高,表明肠黏膜上皮细胞增殖速率大幅提升。进一步研究发现,水凝胶治疗后,瘘管组织中机械敏感离子通道Piezo2、肠干细胞标志物LGR5以及关键机械信号转导分子YAP的表达均显著上调,同时微血管密度(CD31、αSMA标记)显著高于对照组,证实水凝胶通过调节机械敏感性、促进干细胞增殖和血管生成,多维度加速愈合进程。

图4:GNGP机械活性水凝胶诱导兔模型肠道瘘管修复
机制研究层面,通过有限元模拟精准解析了GNGP水凝胶密封肠道瘘管时的机械刺激作用,体外构建的剪切应力刺激平台验证了其核心作用路径:水凝胶收缩产生的剪切应力,可通过Yes相关蛋白(YAP)介导的机械敏感性调控肠上皮细胞增殖。EdU染色结果显示,剪切应力刺激后增殖细胞数量明显增加;转录组和Western blot分析证实,这一过程可上调PI3K和MAPK信号通路相关蛋白表达;而使用YAP抑制剂维替泊芬后,剪切应力对肠上皮细胞增殖的促进作用显著减弱,AKT和ERK的磷酸化水平明显降低,明确了YAP是剪切应力促进肠上皮细胞增殖的关键介导分子。
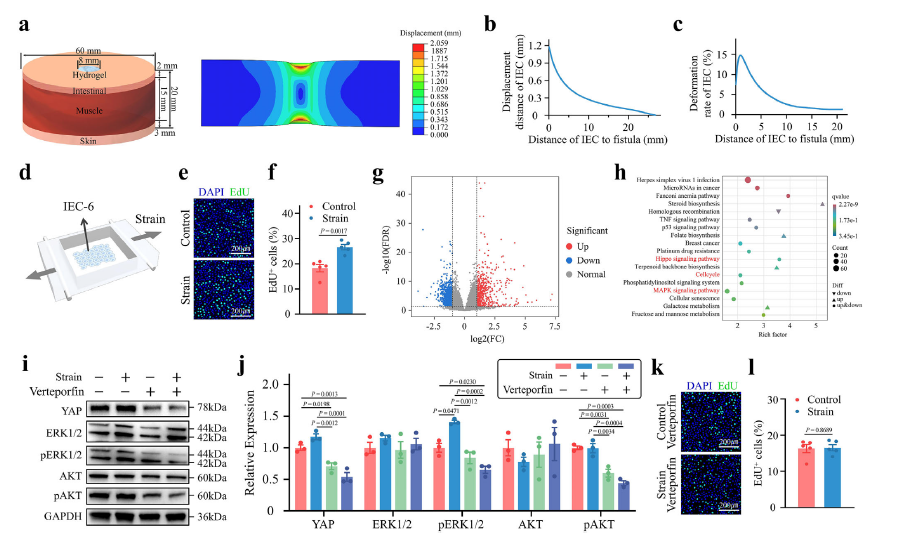
图5:拉伸诱导的YAP激活促进肠上皮细胞增殖
这项研究成功突破了传统肠道瘘管治疗的技术瓶颈。GNGP水凝胶集可注射性、体温响应机械活性、广谱抗菌、强组织粘附和精准降解等优势于一体,通过“密封-抗炎-增殖-修复”的全链条作用模式,为肠道瘘管提供了微创、高效、安全的治疗新选择。它不仅能减少患者手术创伤和并发症风险,更有望拓展应用于食管瘘、胰腺瘘、直肠阴道瘘等其他瘘管病症,推动整个瘘管治疗领域的技术革新。未来,随着临床转化的推进,这款“体温激活型”智能修复凝胶将为更多患者带来康复希望,彻底改变瘘管治疗的临床格局。(生物谷Bioon.com)
参考文献:
Li Z, Li J, Chen K, et al. Mechanically Active Hydrogel for Healing Intestinal Fistulas through the YAP-Mediated Mechanosensitization of Intestinal Epithelial Cells. Adv Sci (Weinh). 2025;12(43):e10717. doi:10.1002/advs.202510717
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


