《自然》子刊:青春期睡不好,成年后不爱新社交!科学家发现,青春期小鼠连续5天少睡4小时,会导致成年后社交新奇性降低
来源:奇点糕 2022-06-29 09:37
睡眠是我们生活的必需品,睡眠时间大概占据了生命的1/3,它的功能也不可小觑,比如代谢修复,以及在神经可塑性和记忆巩固中发挥解毒和认知干预的功能,不过,这些基本都是在成年人中发现的。
睡眠是我们生活的必需品,睡眠时间大概占据了生命的1/3,它的功能也不可小觑,比如代谢修复,以及在神经可塑性和记忆巩固中发挥解毒和认知干预的功能,不过,这些基本都是在成年人中发现的。
同样,对睡眠不足影响的研究通常也局限于成年之后,然而,从婴儿到青少年时期,再到成年,睡眠的功能有清晰的发展轨迹,例如,总睡眠时间逐渐减少,与成年时期相比,发育时期睡眠的脑电图显示,涉及记忆与认知的过程明显更多[1-3]。那么,青少年时期缺少睡眠的话,会产生怎样的影响呢?
最近的《自然·神经科学》杂志发表了一项新的研究[4],斯坦福大学医学院的研究人员在小鼠模型中发现,青少年时期的睡眠中断,会降低成年后小鼠与陌生小鼠的社交意愿,这与多巴胺分泌模式的改变有关。

研究人员选择了出生后35-42天,青春期中期的小鼠,让它们每天少睡4个小时,连续5天。这几天的睡眠中断(SD)没有永久性地改变小鼠的睡眠结构,也没有让它们产生什么急性应激反应。
表面上看,这只是一个小插曲,但是到了成年期(56天)后,SD小鼠和一起长大的对照组小鼠在社交行为上出现了明显的不一致。
对照组小鼠很自然地、普普通通地就对陌生小鼠产生了好奇,积极与它们社交,但是SD小鼠却不是这样,它们对陌生小鼠不怎么感兴趣,更倾向于和熟悉的小鼠贴贴。不过,在和每个小鼠每次的社交时长、总社交时长和其他各种衡量社交的参数方面,研究人员没有发现明显差异。也就是说,SD小鼠只是出现了社交新奇性方面的缺陷。
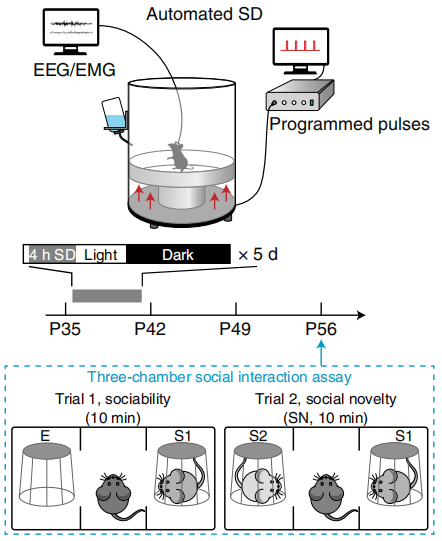
睡眠中断和社交实验设计
这种缺陷既不是由于SD的慢性压力导致的,也不因性别不同而改变。
在青春期末尾(42-49天)的小鼠中重复实验,也得到了同样但稍弱的社交新奇性缺陷的结果,而在成年期的小鼠中,SD并不会导致这种缺陷。
青少年时期的SD是否是通过影响了大脑的结构才导致了社交新奇性的缺陷呢?
研究人员把研究重心锁定在了腹侧被盖区(VTA)的多巴胺能信号通路上,这是已知的调节社会性和社交新奇性偏好的重要通路[5,6]。
他们使用光纤光度法和Ca2+瞬态检测方法等技术,探索了小鼠们社交时,VTA多巴胺能神经元的活性变化,结果显示,VTA多巴胺能神经元的整体活性没有明显不同,但是对照组小鼠存在一种社交新奇性依赖性的VTA激活模式,当小鼠们第一次见陌生小鼠时,神经元激活最为显著,随后随接触次数增加呈指数级下降,而这种模式在SD小鼠中不存在。
VTA多巴胺能神经元在社会行为方面的作用主要依赖于在中皮层边缘通路的投射输出,也就是腹侧纹状体(NAc)和前额皮质(PFC)。通过检测NAc中的多巴胺释放情况,他们确认,SD小鼠在遇见陌生小鼠时,没有检测到多巴胺的释放,也就是说,SD小鼠和陌生小鼠接触时无法获得多巴胺这种大脑的奖励信号。
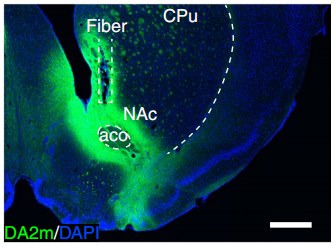
将光纤放置到NAc和免疫染色(绿色)结果
多巴胺信号的传递与传统的神经突触传递不太一样,是一种更加分散的信号传递,研究人员采取双标记策略,检测了从VTA多巴胺能神经元到NAc和PFC的多巴胺的传递。结果显示,SD小鼠的多个信号传递靶点发生了变化,而且从VTA到NAc的传递异常加强。这表明,青少年时期的SD可能会干扰发育过程中VTA多巴胺能神经元信号传递的精确化过程。
通常,VTA多巴胺能神经元在清醒状态下高度活跃,在睡眠状态下保持沉默,因此,研究人员猜想,青少年时期的SD可能使得VTA多巴胺能神经元活跃时间增加,被“过度使用”了。他们在小鼠中对此进行了验证。
采取药物诱导的方式,研究人员直接模拟了青春期小鼠连续5天SD的状态,与对照组相比,实验组小鼠确实在保持了整体社交能力没有显著变化的前提下,丧失了社交新奇性偏好,与SD小鼠一样。它们的VTA多巴胺能神经元信号传递过程的变化也是一致的。
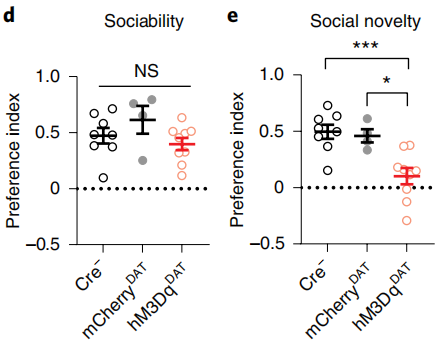
实验组小鼠(红)整体社交能力没有显著变化(d),社交新奇性偏好丧失(e)
这些现象都论证了青春期的SD对社交新奇性偏好的影响。
一些神经发育障碍疾病患者也存在睡眠障碍和社交新奇性缺陷,例如自闭症谱系障碍(ASD)。研究人员在模拟ASD的存在Shank3突变小鼠中发现,这类小鼠和SD小鼠具有相似的社交新奇性缺陷和VTA到NAc多巴胺信号传递异常加强的特点。
利用辅助睡眠的药物,研究人员发现,这可以帮助Shank3突变小鼠恢复睡眠和社交新奇性。另一种方法是在睡眠中断时间内沉默VTA多巴胺能神经元,也可以起到同样的效果。
在同期配发的评论文章[7]中,评论员指出,这项研究是建立睡眠与社会性发展之间因果关系的关键第一步,即青少年时期的睡眠状态可能是一个隐藏的环境因素,塑造成年后的人格特征,例如性格外向性的程度。尽管机制方面还不是十分明确,但这为这一领域的未来研究奠定了基础。另外,也为在青少年时期睡眠干预治疗的潜力提供了重要的观点和证据。
参考文献:
[1] Campbell I G, Feinberg I. Longitudinal trajectories of non-rapid eye movement delta and theta EEG as indicators of adolescent brain maturation[J]. Proceedings of the National Academy of Sciences, 2009, 106(13): 5177-5180.
[2] De Vivo L, Faraguna U, Nelson A B, et al. Developmental patterns of sleep slow wave activity and synaptic density in adolescent mice[J]. Sleep, 2014, 37(4): 689-700.
[3] Timofeev I, Schoch S F, LeBourgeois M K, et al. Spatio-temporal properties of sleep slow waves and implications for development[J]. Current opinion in physiology, 2020, 15: 172-182.
[4] Bian W J, Brewer C L, Kauer J A, et al. Adolescent sleep shapes social novelty preference in mice[J]. Nature Neuroscience, 2022: 1-12.
[5] Bariselli S, Hörnberg H, Prévost-Solié C, et al. Role of VTA dopamine neurons and neuroligin 3 in sociability traits related to nonfamiliar conspecific interaction[J]. Nature Communications, 2018, 9(1): 1-15.
[6] Gunaydin L A, Grosenick L, Finkelstein J C, et al. Natural neural projection dynamics underlying social behavior[J]. Cell, 2014, 157(7): 1535-1551.
[7] McHenry J A. Adolescent sleep molds adult social preferences[J]. Nature Neuroscience, 2022: 1-3.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


