组蛋白研究进展速览!
来源:本站原创 2019-09-27 23:19
本文中,小编盘点了多篇研究报告,共同解析科学家们在组蛋白研究上取得的新成就,与大家一起学习!图片来源:Daniel N. Weinberg et al,doi:10.1038/s41586-019-1534-3【1】Nature:揭示组蛋白标记H3K36me2招募DNMT3A并影响基因间DNA甲基化doi:10.1038/s41586-019-1534-3催化DNA中CpG甲基化的酶,包括DNA甲
本文中,小编盘点了多篇研究报告,共同解析科学家们在组蛋白研究上取得的新成就,与大家一起学习!
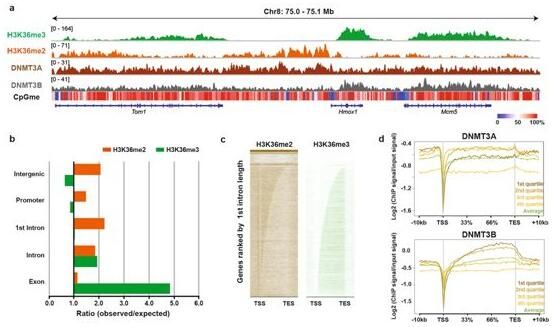
图片来源:Daniel N. Weinberg et al,doi:10.1038/s41586-019-1534-3
【1】Nature:揭示组蛋白标记H3K36me2招募DNMT3A并影响基因间DNA甲基化
doi:10.1038/s41586-019-1534-3
催化DNA中CpG甲基化的酶,包括DNA甲基转移酶1(DNMT1)、DNA甲基转移酶3A(DNMT3A)和DNA甲基转移酶3B(DNMT3B)。这些DNA甲基转移酶对于哺乳动物组织发育和体内平衡是必不可少的。它们还与人类发育障碍和癌症有关,这就支持DNA甲基化在细胞命运的指定和维持中起着关键作用。之前的研究已表明组蛋白的翻译后修饰参与了确定启动子和活跃转录基因体的DNA甲基转移酶定位和DNA甲基化的模式。然而,控制基因间DNA甲基化的建立和维持的机制仍然知之甚少。
在一项新的研究中,来自美国哥伦比亚大学欧文医学中心、洛克菲勒大学和加拿大麦吉尔大学等研究机构的研究人员报道NSD1介导的H3K36me2是在基因间区域招募DNMT3A和维持DNA甲基化所必需的,相关研究结果发表在Nature期刊上,全基因组分析表明DNMT3A的结合和活性与常染色质的非编码区域的H3K36me2共定位。在小鼠细胞中剔除基因Nsd1及其旁系同源物Nsd2导致DNMT3A重新分布到H3K36me3修饰的基因体上并且减少基因间DNA的甲基化。
【2】Science:我国科学家揭示人类早期胚胎发育中的组蛋白修饰重编程
doi:10.1126/science.aaw5118
在真核生物中,组蛋白与带负电荷的双螺旋DNA组装成核小体。因氨基酸成分和分子量不同,组蛋白主要分成5类:H1,H2A,H2B,H3和H4。除H1外,其他4种组蛋白均分别以二聚体形式相结合,形成核小体核心。DNA便缠绕在核小体的核心上。而H1则与核小体间的DNA结合。组蛋白修饰(histone modification)是指组蛋白在相关酶作用下发生甲基化、乙酰化、磷酸化、腺苷酸化、泛素化、ADP核糖基化等修饰的过程。
组蛋白上发生甲基化的位点是赖氨酸和精氨酸。赖氨酸能够分别发生一、二、三甲基化,精氨酸只能发生一、二甲基化。在组蛋白H3上,共有5个赖氨酸位点可以发生甲基化修饰。一般来说,组蛋白H3K4的甲基化主要聚集在活跃转录的启动子区域。组蛋白H3K9的甲基化与基因的转录抑制及异染色质有关。H3K27甲基化可导致相关基因的沉默,并且与X染色体失活相关。H3K36的甲基化与基因转录激活相关。组蛋白修饰调节基因表达和发育。在一项新的研究中,为了解决在人类早期发育中组蛋白修饰如何发生重编程,来自中国的科学家研究了人卵母细胞和早期胚胎中的关键组蛋白标记,相关研究结果发表在Science期刊上。
【3】Nature:研究发现各种癌症组织中广泛存在的致癌组蛋白!
doi:10.1038/s41586-019-1038-1
所有的肿瘤都和细胞生长失控有关,但是细胞最初生长失控的方式却有成千上万种。肿瘤中存在大量突变的蛋白质,其中一类叫做组蛋白,这种蛋白质的正常功能是包装DNA帮助调节基因表达。但是根据一项由洛克菲勒的科学家完成、发表在《Nature》上的最新研究,肿瘤中所谓的肿瘤组蛋白远比我们过去认为的更常见。过去十年里,C. David Allis和其他人已经研究了和不同肿瘤相关的突变组蛋白,比如一些脑癌和骨癌。基于这些研究,Allis(Joy and Jack Fishman教授)与访问学者Benjamin Nacev及其他同事一起决定研究其他种类的肿瘤中是否也存在肿瘤组蛋白。
Nacev是纪念斯隆凯特琳癌症中心的医学肿瘤学研究员,他利用医院的肿瘤测序数据库和其他可获得的公共数据去确定不同肿瘤中的组蛋白突变的频率。他和他的同事发现他们分析的样品中有4%的样品出现了肿瘤组蛋白——这远远高于过去的报道。研究人员还发现这些突变影响着过去未发现的组蛋白。
【4】Science:在DNA复制期间,蛋白MCM2促进组蛋白中的表观遗传信息在两条新的DNA链中均匀分布
doi:10.1126/science.aau0294
在一生当中,细胞持续地分裂。但是细胞在发生分裂时是如何记住产生皮肤细胞,肝细胞还是肠道细胞的呢?这个问题困扰了科学家多年。在人细胞内,我们的DNA被组蛋白包裹着。它们一起形成一种称为染色质的结构。当细胞发生分裂时,DNA和整个染色质结构都被准确地复制是至关重要的。染色质储存着影响哪些基因表达的表观遗传信息。这就是说,我们细胞中的表观遗传信息有助于控制哪些基因“开启”和“关闭”。
如今,在一项新的研究中,来自丹麦哥本哈根大学的研究人员开发出一种被称作SCAR-seq的新技术,这使得他们解决了储存在组蛋白中的表观遗传信息在DNA复制和细胞发生分裂时是如何传递的问题,并且成功地鉴定出一种当细胞发生分裂时负责细胞记忆传递的蛋白,即MCM2,相关研究结果发表在Science期刊上。
【5】Cell Reports:研究揭示组蛋白伴侣调控神经干细胞机制
大脑皮层是哺乳动物大脑中高度发达的中枢区域,负责控制认知、记忆、情感行为等重要机体功能。正常胚胎大脑皮层发育对于维持皮层功能十分关键,全面深入了解胚胎大脑皮层发育机理及调控机制具有重要意义。胚胎大脑皮层发育过程受到细胞内外多种信号分子的精准调控,以保证大脑正常发育的时序性。表观遗传调控是皮层发育过程中的关键调控因素。组蛋白伴侣Nap1l1与组蛋白结合参与染色质的组装和去组装,对染色质结构的稳定及基因表达调控具有重要的功能,在细胞周期调控、细胞极性和组蛋白运输方面也发挥着必不可少的作用,但其在脑发育过程中对神经干细胞增殖及分化过程中的功能和机制目前未知。
近日,中国科学院动物研究所焦建伟研究组在确定了Nap1l1胚胎脑发育过程中的表达变化及分布基础上,通过胚胎电转实验发现,Nap1l1敲降后神经干细胞增殖减少,神经元分化水平增加。通过CRISPR-Cas9技术构建的Nap1l1敲除小鼠进一步确定了其表型。研究结果显示,Nap1l1能够与SETD1A结合促进下游基因RassF10启动子上H3K4me3的水平,从而促进RassF10的表达。过表达RassF10能够挽救Nap1l1敲降造成的胚脑发育过程中细胞分布、增殖及分化的异常。该研究揭示了组蛋白分子伴侣Nap1l1在早期胚胎脑发育过程中对神经干细胞调控的重要作用,有助于探索Nap1l1相关疾病病理。
【6】NAR:揭示支架蛋白BRPF2调控组蛋白乙酰转移酶HBO1活性的分子机制
近日,Nucleic Acids Research杂志在线发表了中国科学院生物化学与细胞生物学研究所国家蛋白质科学中心(上海)丁建平研究组的最新研究成果,该研究工作揭示了支架蛋白BRPF2调控MYST家族乙酰转移酶HBO1对于组蛋白H3K14乙酰化酶活的分子基础。
组蛋白的乙酰化是一种重要的表观遗传修饰,其与染色质的组装形式尤其是染色质的解聚及疏松程度密切相关。不同的乙酰化程度决定了染色质特定位点基因的表达强弱,并进一步影响到DNA复制与修复、细胞分化及发育等多种生理过程。在体内,由组蛋白乙酰转移酶(histone acetyltransferase, HAT)负责对组蛋白上特定位点的赖氨酸残基进行乙酰化。HBO1属于MYST组蛋白乙酰转移酶家族,其对于H3、H4及其它非组蛋白底物都具有广谱的酶活性。在体内它能够与支架蛋白BRPF或JADE及辅助蛋白ING4/5和Eaf6形成稳定的复合物。
doi:10.1038/nsmb.3347
日前,一项刊登在国际杂志Nature Structural & Molecular Biology上的研究报告中,来自瑞士巴塞尔弗雷德里希米歇尔生物医学研究所的研究人员通过研究揭开了组蛋白降解如何伴随DNA修复效应的产生。此前研究中研究者发现,当染色质的物理行为发生改变时就会导致DNA损伤,此时,双链断裂发生位点的运动就会增强,进而转变为高度的动态性;此外研究者还能够在和DNA损伤相对应的细胞核的未损伤位点中观察到相同的效应。
为了深入阐明这种现象发生的原因,研究者就通过研究发现,组蛋白能够从DNA上分离下来,而且大约30%的组蛋白能够在DNA损伤的情况下发生降解,而这种过程能够被所谓的检查点反应所控制,而且核小体密度的降低不仅能够增加DNA的可动性,还能够增加染色质进行重组介导修复的可能性。
【8】Genome Res:深入研究组蛋白修饰机制或可帮助理解基因调节模式
doi:10.1101/gr.201038.115
近日,刊登在国际杂志Genome Research上的一篇研究论文中,来自新加坡A*STAR研究所的研究人员通过研究发现特殊类型的组蛋白修饰的独特功能,这对于理解基因调节以及疾病的发生非常重要。
组蛋白是细胞核中的特殊蛋白,其可以组织DNA形成名为核小体的结构单位,帮助保护DNA以及控制基因的表达,目前有5种主要的组蛋白家族,不同家族的组蛋白有着不同的修饰表现。文章中研究者通过全基因组来观察分析这些组蛋白修饰的模式,目的在于理解基因调节和疾病发生的过程,比如一种名为组蛋白乙酰化作用的组蛋白修饰和用以基因调节和增强转录的DNA不同位点的激活直接相关,然而对于组蛋白及其功能的表现研究者还有待于深入研究。目前有35种已知的组蛋白乙酰化作用,其中很多乙酰化作用并没有明确的特征,大多数的调节基因组研究也将目光聚焦于H3K27ac和H3K9ac两种组蛋白的乙酰化作用上。
【9】Science:特殊技术可解析组蛋白修饰奥秘 助力基因调节机制的理解
doi:10.1126/science.aad7701
刊登在国际杂志Science上的一项研究报告中,来自麻省总医院、哈佛大学医学院及博德研究所的研究人员通过研究设计出了一种新方法,该方法可以帮助解析组蛋白的修饰过程,进而阐明基因调节的特殊机制,同时文章中研究人员还对单一核小体组合性修饰的模式进行了图谱的绘制。
为了确定一种基因是否可以被激活,或者和缠绕在DNA链上的组蛋白结构的共价修饰没有关联,研究人员就需要更好地理解组蛋白的修饰编码机制;这项研究中研究者就设计了一种可以解析组蛋白改变的特殊技术,这项技术主要以多能干细胞和谱系定型细胞开始,随后研究者挑选出特殊的核小体(包含组蛋白和DNA链的包裹结构),并且利用荧光物质对DNA链的末端进行标记。
【10】Genes Devel:组蛋白修饰的特殊标记或是开发长寿疗法的新型靶点
doi:10.1101/gad.254144.114
对DNA缠绕的修饰蛋白进行研究或可帮助阐明线虫、果蝇等生物基因调节和老化及长寿的关系,同时也可以为开发治疗年龄相关疾病的新型靶向药物提供希望。近日,一篇发表于国际杂志Genes and Development上的研究论文中,来自康奈尔大学的研究人员发表了其对组蛋白H3进行特殊修饰的研究。
如果说组蛋白就是线轴,那么DNA就是缠绕在线轴上螺线;组蛋白对于包装细胞内的DNA非常必要,而其也可以被以多种方式所修饰,这些方式都可以影响DNA的包装形式以及基因的开启与关闭。名为H3K36me3的H3组蛋白的修饰指的是在H3蛋白的特殊位点上进行化学标记。研究者Sylvia Lee表示,我们描述了H3修饰的全基因组模式,随后描述了年幼和年长的秀丽隐杆线虫机体所有基因的表达,结果发现当基因(DNA)缠绕在H3上时,如果H3的修饰水平较低,那么基因的表达就趋向于随着年龄增长而发生波动,同时如果H3处于高水平修饰的状态,那么基因的表达就会随着年龄增长而保持稳定的状态。(生物谷Bioon.com)
生物谷更多精彩盘点!敬请期待!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


