研究揭示WIPI蛋白结合ATG2并调控细胞自噬的分子机制
来源:生物物理所 2020-06-05 12:29
6月1日,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院生物物理研究所冯巍课题组题为Multi-site-mediated entwining of the linear WIR-motif around WIPI β-propellers for autophagy 的研究论文。该研究主要通过生物化
6月1日,国际学术期刊《自然-通讯》(Nature Communications)在线发表了中国科学院生物物理研究所冯巍课题组题为Multi-site-mediated entwining of the linear WIR-motif around WIPI β-propellers for autophagy 的研究论文。该研究主要通过生物化学和结构生物学等手段,揭示了WIPI蛋白识别、结合ATG2并调控自噬体形成的分子机制。
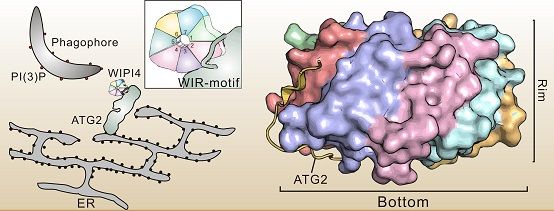
自噬是真核细胞中一种高度保守的自身降解途径。自噬过程通过细胞内容物的降解和循环利用,在维持细胞内稳态平衡、避免有害蛋白聚集体积累以及抵御病原入侵等方面都发挥着重要作用。WIPI蛋白家族是自噬起始信号PI3P脂质的效应分子,其可以招募其他因子对自噬体形成进行调控。WIPI家族蛋白可以特异性识别ATG2蛋白中的一段线性序列(WIR-Motif)形成WIPI/ATG2复合物,定位到吞噬泡和内质网的交界处,促进自噬体的延伸与闭合。然而,两者之间的识别模式及其调控自噬体形成的机制却不清楚。
冯巍课题组在前期WIPI蛋白的研究基础上(JMB,2019),通过融合表达方式获得了稳定的WIPI3/ATG2A-WIR-Motif蛋白复合物,并解析得到其高分辨率晶体结构。结构表明,ATG2A-WIR-Motif蛋白"缠绕"在"圆盘"状WIPI3蛋白的底面和侧面。两者相互作用涉及到WIPI蛋白上的多个位点,而结合位点处氨基酸的突变会破坏WIPI/ATG2复合物的形成进而影响自噬的发生。值得注意的是,许多已知疾病相关的点突变恰好分布在该相互作用界面上,相关生化实验也表明,这些点突变的引入会破坏WIPI蛋白与ATG2的相互作用,从而解释了这些点突变的致病机制。该研究还提出了WIPI蛋白"多位点"介导的全新底物识别模式,并定义了WIPI3/4蛋白识别的氨基酸序列特征,为进一步研究WIPI蛋白在细胞自噬调控中的作用提供了重要基础。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


