《科学·进展》:北大团队从中药野马追中分离到治疗神经退行性疾病的天然分子!
来源:奇点糕 2022-09-23 16:26
近些年来,神经退行性疾病如帕金森病和阿尔茨海默症等,引起了社会的关注。由于人口结构老龄化,神经退行性疾病的发病率越来越高,但与此同时,与之相关的药物研发并没有突破性进展,十分曲折。
近些年来,神经退行性疾病如帕金森病和阿尔茨海默症等,引起了社会的关注。由于人口结构老龄化,神经退行性疾病的发病率越来越高,但与此同时,与之相关的药物研发并没有突破性进展,十分曲折。因此,发现新的治疗神经退行性疾病的药物靶点显得至关重要。
炎症反应是免疫系统面对感染和损伤时的一种防御机制,中枢神经系统也不例外。在面对各种感染、脑损伤或毒素等信号时,神经系统中的免疫细胞,如小胶质细胞等就会被激活,产生一系列神经性炎症。正常的神经炎症反应可以修复损伤组织,对神经系统起到保护作用;而异常的神经炎症反应,则与神经退行性疾病的发生和进展有很大的关联。通常,与神经退化相关的异常神经炎症是由小胶质细胞的激活引发的,如此看来,从抑制小胶质细胞的激活来下手,可能有利于神经退行性疾病的治疗。
这次,北大的屠鹏飞/曾克武团队就在中药材中挖到了宝。
屠鹏飞/曾克武团队发现,从中药野马追分离出的天然小分子,野马追内酯B(EB),可以通过去泛素化酶USP7来抑制小胶质细胞的激活,从而达到抗神经炎症的作用。这项研究首次揭示了去泛素化酶USP7是潜在的治疗神经退行性疾病的药物新靶点,为神经退行性疾病的药物研发提供了理论基础。文章于近期发表于Science Advances上 [1]。

论文首页截图
野马追是一种常见的用于治疗慢性支气管炎的中药材,而野马追内酯B(EB)是从中分离出来的半萜类化合物。
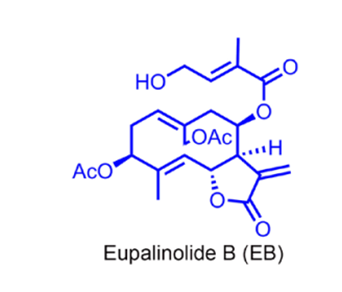
Figure 1. 野马追内酯B
在这项研究中,研究人员首先通过高通量筛选发现,EB可以通过下调一氧化氮(NO)、白介素-6(IL-6)以及肿瘤坏死因子-α(TNF-α)等炎症介质来抑制BV-2小胶质细胞。
为确定其机理,他们合成了生物素-野马追内酯B(Bio-EB),并应用该探针初步证实了去泛素化酶USP7是EB的靶标蛋白。为了检测EB与USP7结合的特异性,他们使用表面等离子共振(SPR),测出EB和USP7的解离常数为6.85 µM,在34个去泛素化酶(USPs)家族蛋白中,EB能够特异性结合USP7。
泛素化是广泛存在于自然界中的翻译后修饰,被泛素标记的蛋白会被细胞降解。与此同时, USPs也可以逆转泛素化的过程,去除泛素化修饰。其中,USP7是一个存在于所有真核细胞中的去泛素化酶。目前关于USP7与小胶质细胞介导的神经性炎症关联的研究还不是很多。
在这里,为验证小胶质细胞被抑制是由于EB与USP7的结合,研究人员使用siRNA技术干扰了USP7的表达,在USP7被抑制表达的小胶质细胞中,由EB引起的一系列炎症介质的下调均被逆转。
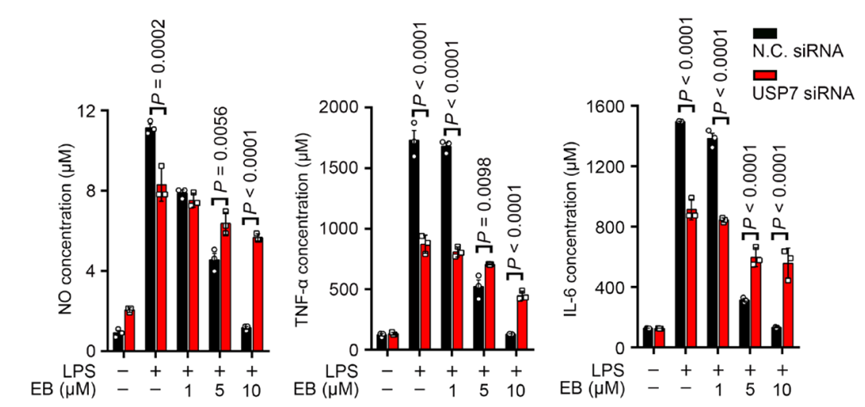
Figure 2. siRNA干扰USP7表达后,EB介导的炎症因子下调均被逆转
以上一系列实验证明,EB与USP7特异性结合,从而抑制小胶质细胞介导的炎症反应。
接下来,研究者利用SRP实验、蛋白结构重构解析、荧光共振能量转移实验(FRET)等技术,对EB和USP7的结合模式与位点进行深入探索。
结果发现,EB是通过与USP7的非催化位点HUBL结构域结合,以达到对USP7的别构抑制。在静息状态下USP7处于一种开放式构象,从而达到自我抑制的作用,而泛素化底物的结合则会引导其形成关闭式构象以发挥催化作用。EB的插入会诱导USP7形成一种过度开放的构象,从而抑制其发挥去泛素化作用。这种新的作用模式在之前并未被报道过。并且研究者进一步证明,USP7的Cys576是EB抑制小胶质细胞、发挥抗炎作用的关键位点。
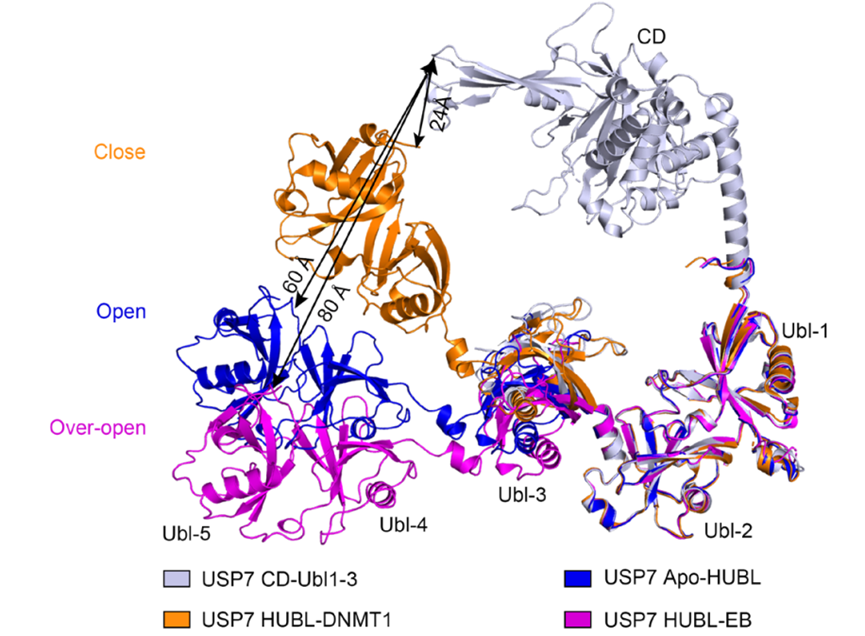
Figure 3. USP7的关闭、开放和过度开放构象
那么,USP7又是如何与小胶质细胞挂上勾的呢?要知道,USP7能够作用于多种泛素化体物,能够激活小胶质细胞的究竟是哪种蛋白底物呢 ?
借助稳定同位素标记(SILAC)和定量蛋白组学分析,能够对EB产生响应的蛋白底物Kelch-like ECH-associated protein 1 (Keap1)成功引起了研究者们的注意,而且Keap1已被证明在炎症反应中发挥着重要作用。
进一步研究表明,EB通过抑制USP7的去泛素化,加快其蛋白底物Keap1的降解,从而调节Keap1/Nrf2信号通路来抑制炎症反应。同时还揭示了USP7和Keap1的结合区域,不过值得注意的是,EB并不直接结合于Keap1。
了解到这些之后,轮到小鼠出场了。
在开始小鼠体内实验之前,研究人员测试了EB的药代动力学特性。通过测量胃内给药0.25~3小时之后的血浆和脑内的EB浓度,他们得出结论,EB具有良好的口服生物利用度,能够透过血脑屏障达到其治疗浓度。
随后他们开始了EB的体内实验。他们构建了带有一个Usp7无效等位基因的老鼠模型(Usp7+/−),以检测EB是否影响小胶质细胞的标志物Iba-1和CD68的表达。
结果显示,在Usp7WT小鼠模型中,由细菌脂多糖刺激产生的Iba-1和CD68表达均被EB所抑制,并且EB能够更有效地减少分枝点,保护小胶质细胞的形态,减少促炎因子如TNF-α 和 IL-6的产生,具有显著的神经保护作用。以上现象在Usp7+/−小鼠中均未被发现。
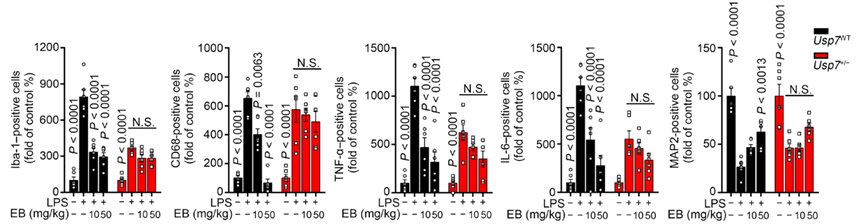
Figure 5. Usp7WT和Usp7+/−小鼠模型中Iba-1, CD68, TNF-α, IL-6, 和MAP2 IHC染色随EB浓度变化
不仅如此,他们还在Nfr7WT和Nfr-/-小鼠模型实验中再次证明,EB通过调节USP7-Keap1/Nrf2通路,来抑制小胶质细胞的激活,发挥抗神经炎症作用。
最后,研究人员探索了EB治疗神经退行性疾病的可能性。
他们使用遗传性快速老化促进小鼠模型(SAMP8)来模拟衰老相关的痴呆症状,并进行水迷宫实验。
结果发现,使用EB治疗的SAMP8小鼠模型,在第5天记忆力就有了显著的提升,大脑皮质和海马体中由于衰老减少的尼氏体在EB的作用下也显著增加。与其对照品系SAM抗性小鼠(SAMR1)相比,未使用EB治疗时SAMP8小鼠脑中Iba-1和CD68更多,但是使用EB之后,这些标志物明显下降。而且EB能够更有效地减少小胶质细胞的分枝点,保护小胶质细胞的形态,减少TNF-α和IL-6的产生,提高了NQO1和HO-1的表达,具有显著的神经保护作用。
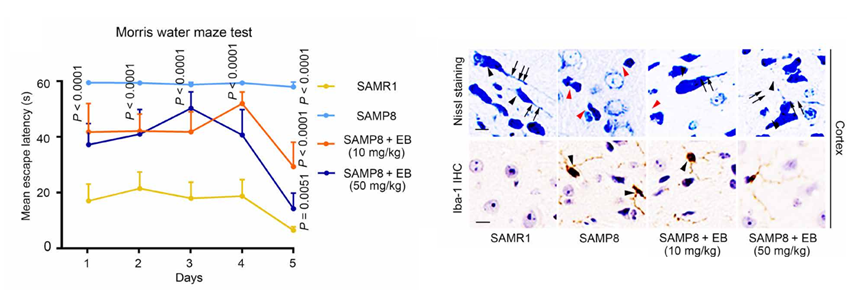
Figure 6. 左:水迷宫实验;右:Iba-1 SAM小鼠大脑皮质IHC染色和尼氏染色
随后,他们在帕金森小鼠模型中也证明了EB的神经保护作用和对神经性疾病的逆转效果。
本项研究首次揭示了USP7与神经退行性疾病的联系,并发现其非催化域HUBL是一个潜在的药物研发的靶点。野马追内酯B作为首个靶向于USP7非催化域的小分子抑制剂,为之后开发更多USP7抑制剂提供了思路,也为神经退行性疾病的药物研发提供了理论基础。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


