最新研究发现,早期人类胚胎无法有效修复DNA损伤
来源:生物世界 2023-07-04 10:12
近日,在第39届欧洲人类生殖与胚胎学会(ESHRE)年会上,牛津大学 Nada Kubikova 博士做了一项题为:Deficiency of DNA double-strand break repa
早在2015年,科学家们就警告不要使用CRISPR-Cas9基因编辑技术来修改生殖细胞的基因组,担心这可能带来不可预测的后果。然而,这一警告被贺建奎博士忽视了,2018年11月,他宣布了“CRISPR Baby”的诞生,震惊了整个科学界,后续的事情我们也都知道了。
“CRISPR Baby”的研究违反了伦理道德以及法律法规,除此之外,这种对生殖细胞进行的CRSIPR基因编辑对健康是否有负面影响,仍然模糊不清。
近日,在第39届欧洲人类生殖与胚胎学会(ESHRE)年会上,牛津大学 Nada Kubikova 博士做了一项题为:Deficiency of DNA double-strand break repair in human preimplantation embryos revealed by CRISPR-Cas9 的报告,这项报告指出,早期人类胚胎细胞通常无法有效修复DNA损伤,这对于CRISPR-Cas9基因编辑具有重要意义。
CRISPR-Cas9基因编辑可以用来纠正有缺陷的基因,这一过程需要首先破坏DNA双链,导致DNA双链断裂,然后再修复断裂的DNA双链。而这项新研究提示我们,如果将CRISPR-Cas9基因编辑技术应用于人类胚胎,可能产生不必要的、潜在的危险后果。
该报告于2023年6月29日发表于 Human Reproduction 期刊。

Nada Kubikova 博士研究了CRISPR-Cas9基因编辑技术对早期胚胎细胞的DNA的编辑效果,结果显示,CRISPR-Cas9基因编辑技术可以高效靶向胚胎细胞的目标DNA,然而,这很少导致我们所期待的纠正缺陷基因的变化,更可能出现的结果是,导致了DNA双链的永久断裂,这可能导致胚胎出现额外的可遗传的异常变化。这意味着在早期人类胚胎中使用CRISPR-Cas9基因编辑存在重大风险。

Nada Kubikova 博士
基于CRISPR-Cas9的基因编辑技术已经在临床试验中用于治疗镰状细胞病、β地中海贫血等遗传疾病以及癌症的成年人和儿童患者。就在今年6月8日,FDA接受了CRISPR基因编辑疗法 exa-cel 治疗严重镰状细胞病和输血依赖性β-地中海贫血的生物制品许可申请(BLA),同时授予其治疗SCD的优先审评资格。这也是FDA受理的首个CRISPR基因编辑疗法上市申请。
如果可以在胚胎植入子宫之前对其进行基因编辑,那么就可以避免和治疗更多的遗传性疾病,这是因为此时可以保证将来的每个细胞都被进行基因编辑。然而,由于这种方式会导致可能在人类基因组中代代相传的变化,而且其还存在着不确定的安全性,因此几乎所有国家都禁止对人类胚胎进行基因编辑。
Nada Kubikova 博士希望能进一步评估CRISPR-Cas9是否能成为纠正人类胚胎基因错误的有效方法,并阐明这种方法是否安全。
在经过伦理审核批准后,她和同事们使用捐赠的精子与捐赠的卵子进行受精,使用卵胞浆内单精子显微注射,创造了84个胚胎。在33个胚胎中,他们使用CRISPR-Cas9进行基因编辑,在DNA双链上产生断裂,而且,他们靶向的不含任何编码基因的非编码DNA区域,以了解CRISPR-Cas9如何影响胚胎细胞及其DNA,而不去破坏任何基因。其余的51个胚胎作为对照。
我们身体的所有细胞都有着高效机制来修复DNA损伤。在大多数情况下,断裂的DNA链的末端会很快被修复并重新连接起来,这种修复机制非常重要,因为持续未修复的DNA损伤会阻止细胞正常工作,并且可能是致命的。
细胞修复DNA最常见的方式是重新连接DNA链的两端,也就是所谓的非同源末端连接(NHEJ),但这种修复方式会在DNA链重新连接的地方导致一些碱基的丢失或增加,这种修复方式可能会破坏基因,实际上,CRISPR-Cas9基因编辑就是先导致DNA双链锻炼,利用DNA非同源末端连接(NHEJ)修复时的错误,实现对基因的敲除效果。
细胞修复DNA断裂的另一种方法是使用受损区域的完整副本作为模板,复制并替换受损区域,也就是所谓的同源定向修复(HDR),这种修复方式更为精准。在CRISPR-Cas9基因编辑来纠正基因突变时,我们可以提供一段DNA序列(供体序列),细胞在CRISPR-Cas9导致DNA双链断裂后的修复时,就可能利用这些序列作为模板,修复原本的基因突变。
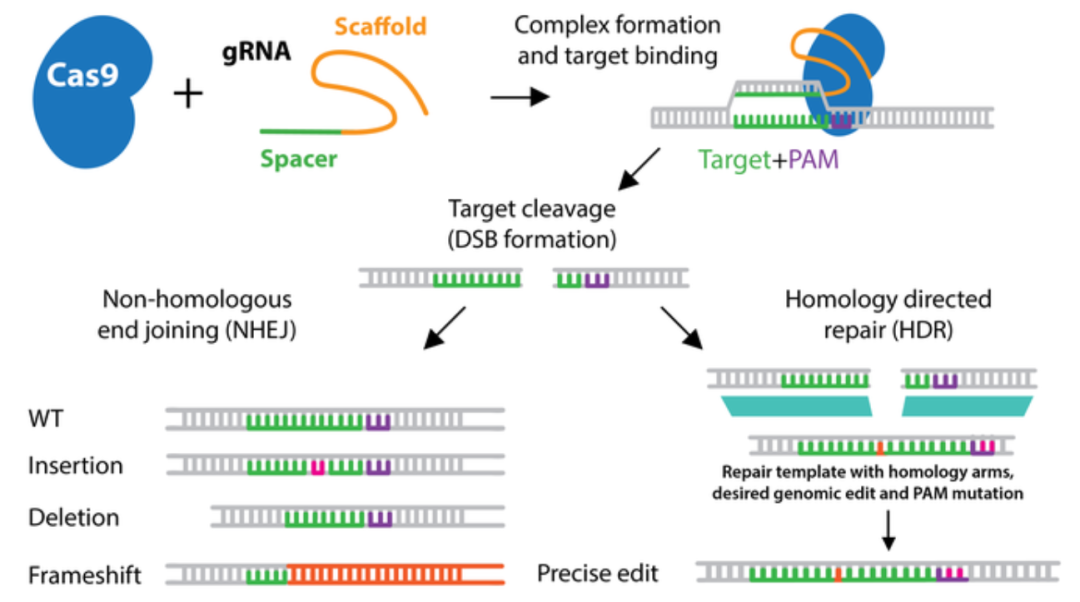
NHEJ修复(左)和HDR修复(右)
在这项研究中,研究团队在25个胚胎中的24个中检测到目标DNA位点的变化,这表明CRISPR-Cas9基因编辑在人类胚胎细胞的效率非常高。然而,只有9%的目标位点通过同源性定向修复(HDR)过程得到修复,而51%的DNA双链断裂位点进行了非同源末端连接(NHEJ),产生了DNA序列突变。其余40%的DNA双链断裂无法修复。DNA链中未修复的断裂最终导致从断裂位置延伸到染色体末端的大段染色体丢失或重复。这种类型的大片段基因组异常会影响胚胎的生存能力,如果受影响的胚胎被移植到子宫并诞生婴儿,他们就有携带严重先天异常的风险。
这项研究表明,在早期人类胚胎中,同源定向修复(HDR)是不常见的,在生命的最初几天,人类胚胎细胞不能有效修复其DNA损伤。CRISPR-Cas9在靶向DNA位点方面非常高效。然而,大多数细胞使用非同源末端连接(NHEJ)修复由CRISPR-Cas9诱导的DNA双链断裂,这一过程引入了额外突变,而不是纠正现有突变。如果尝试使用CRISPR-Cas9来纠正人类胚胎中的遗传性疾病,这将是一个挑战,因为大多数情况下,这种尝试都不会成功。
Nada Kubikova 博士表示,虽然这项研究结果提醒人们不要在人类胚胎中使用CRISPR-Cas9基因组编辑,但也有一些积极发现,表明可以通过修改基因组编辑的方式来降低风险,并提高成功纠正突变的能力,这为未来改进基因编辑技术带来了希望。
平均而言,使用体外受精(IVF)产生的胚胎中只有约四分之一能够成功诞生婴儿。其中一半在被移植到子宫之前就停止了发育。这项研究揭示的胚胎不能有效地修复DNA损伤,可能解释了为什么一些体外受精胚胎不能发育,这一发现可能会改善体外受精治疗。
研究团队表示,接下来团队将寻找新的方法来保护早期胚胎免受DNA损伤,这可能会导致生育治疗的潜在改进。他们还计划探索更温和的基因编辑方法,以避免DNA双链断裂。
总的来说,这项研究进一步强调了为什么在对人类胚胎进行基因编辑之前需要彻底研究和理解基因编辑的重要性。未来,基因编辑可能会成为一种有用的工具来防止婴儿出生时患有遗传疾病,但我们现在还需要时间来确定如何成功使用基因编辑工具而不出现意料之外的风险。这也意味着我们需要对相关研究进行严格地监管。这项研究也让有助于我们理解如何改善生育治疗。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


