Nature:DNA甲基化控制星形胶质细胞的干性
来源:生物探索 2024-10-09 13:41
这项研究揭示了星形胶质细胞和神经干细胞虽然具有相似的转录组,但是具有不同的DNA甲基化组,并且DNA甲基化可以调控星形胶质细胞的干性,为将来再生医学提供新的理论依据。
近日,来自德国癌症研究中心的Ana Martin-Villalba和Simon Anders研究团队在Nature上发表题为DNA methylation controls stemness of astrocytes in health and ischaemia的文章,发现星形胶质细胞和神经干细胞具有相似的转录组和染色质可及性,但是具有不同的甲基化组,干细胞功能是由星形胶质细胞基因的甲基化和干细胞基因的去甲基化调控的,并且大脑缺血损伤诱导星形胶质细胞获得干性需要甲基转移酶DNMT3A介导的甲基化组重编程。

研究人员首先用流式细胞术从小鼠的脑室-亚脑室区分离了神经干细胞(NSC)及其后代,进行了单细胞核小体、甲基组和转录组测序(scNMT-seq),检测基因表达、基因组范围DNA甲基化和染色质可及性,将他们的单细胞转录组与一个更大scRNA-seq 参考数据库整合在一起,可以坚定到先前描述的14个休眠NSCs (qNSC1)、静止NSCs (qNSC2)、活跃NSCs (aNSC)、TAPs、神经母细胞和神经元,以及一些少突胶质细胞,从表观组分子层数据也可以将这些细胞类型区分开,说明DNA甲基化和染色质可及性在这一谱系中具有动态变化。然后他们将表观特征和基因表达想对照来鉴定vSVZ区活跃的调控元件,他们扫描了整个基因组的可变甲基化区域(VMR)和可变可及性区域(VAR),发现VMR比启动子区域更能去测基因表达,并经常出现在(TSS)下游约3kb第一个内含子中,在NSC谱系发生过程中,在TSS下游获得额外甲基化的绝大多数基因的转录表达降低。
转录组数据分层聚类将 qNSC1和qNSC2细胞与来自其他组织的星形胶质细胞聚在一起,然而,甲基组聚类只将qNSC1细胞与其他区域的星形胶质细胞聚类,而qNSC2细胞与NSC谱系的其他细胞聚类,由于qNSC1细胞与纹状体和皮层的星形胶质细胞具有相同的转录组和甲基组,因此他们将其称为vSVZ星形胶质细胞,甲基组数据中最引人注目的是vSVZ星形胶质细胞和qNSC2之间的差异,而二者在基因表达和染色质可及性中的差别不明显,因此,vSVZ星形胶质细胞具有星形胶质细胞的甲基组,在过渡到qNSC2阶段时被重编程为NSC甲基组。
接下来他们想知道在vSVZ星形胶质细胞和qNSC2之间DNA甲基化的区别是否是导致其功能差异的原因,发现低甲基化区域(LMR)附近的许多基因都是高表达的,包括参与氨基酸、离子和胆固醇转运和代谢的基因,由于这些代表星形胶质细胞的基本功能,他们将这些位点标记为星形胶质细胞LMR,而在qNSC2的LMR附近的基因包括参与细胞分化、DNA结合和调控ephrin信号传导(控制神经母细胞迁移和NSC静息态)的基因,他们将这些区域标记为NSC LMR,在这些区域附近的基因高表达。因此,可能是DNA甲基化的差异导致了NSC和星形胶质细胞功能上的差异。
局部缺血损伤会诱导纹状体星形胶质细胞的神经干性程序,产生神经母细胞。他们将2个月大的小鼠进行短暂的大脑缺血损伤,发现缺血损伤诱导大多数vSVZ星形胶质细胞转化成qNSC2态,这些星形胶质细胞并不具有星形胶质细胞的甲基组特征,反而具有NSC的甲基组特征,说明NSC的甲基组对于神经再生和干细胞功能是必需的。最后他们在小鼠纹状体中特异性敲除Dnmt3a,进行缺血损伤,对照组小鼠神经母细胞数目显著增加,而在Dnmt3a敲除小鼠中这一反应被完全抑制,说明Dnmt3a介导的甲基组重塑对于获得神经干性潜能是必需的。
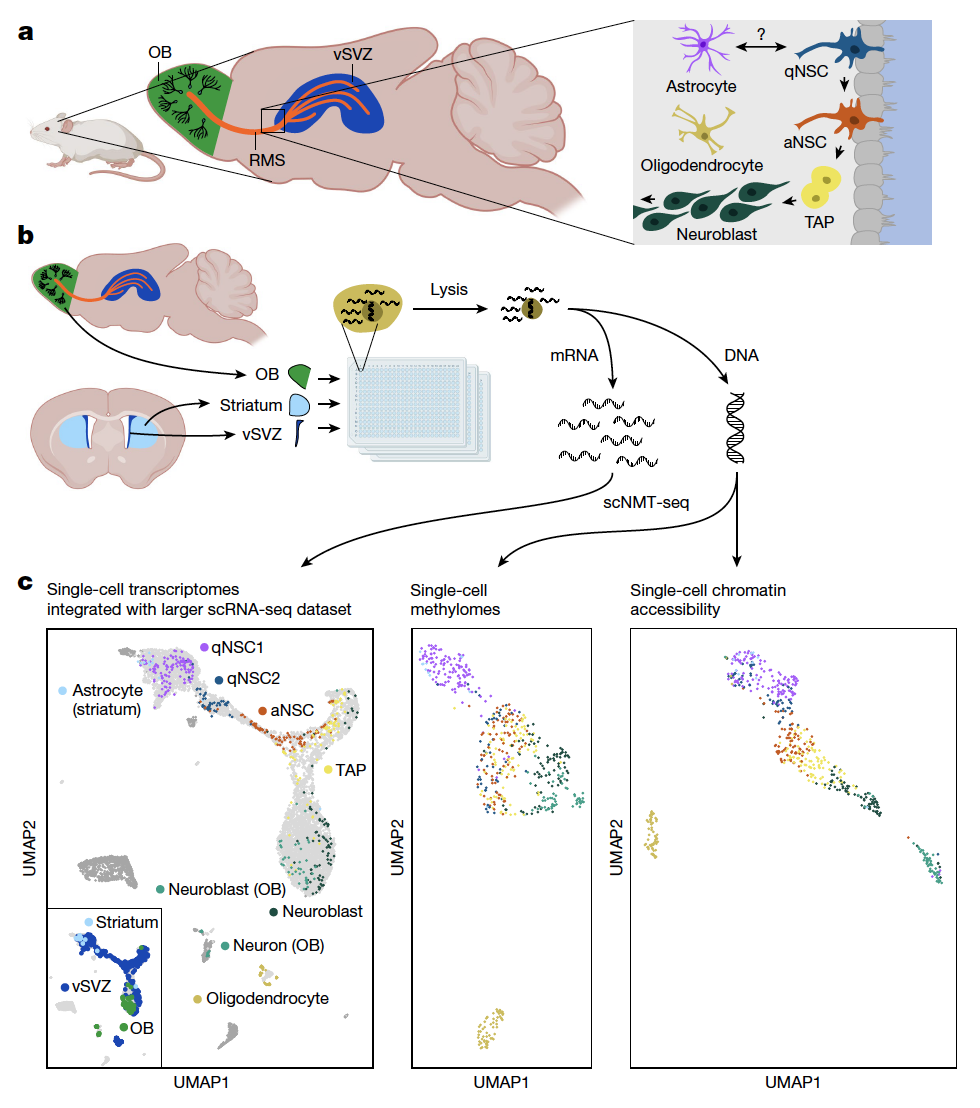
星形胶质细胞和神经干细胞具有不同的甲基化组(Credit: Nature)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


