新洞察!科学家全新揭示了GLT8D1是未来潜在的胶质瘤治疗靶点
来源:本站原创 2022-03-23 14:25
恶性脑瘤大多难以治愈,而胶质瘤是最具侵袭性的类型。替莫唑胺(temozolomide,TMZ)是一种通过DNA甲基化发挥抗肿瘤作用的烷基化药物,是治疗胶质瘤的标准药物。根据异柠檬酸脱氢酶(IDH)突变的情况,胶质瘤主要分为野生型(Wt)和突变型IDH组,与野生型(Wt)IDH瘤相比,IDH突变型胶质瘤患者的临床预后更好。
恶性脑瘤大多难以治愈,而胶质瘤是最具侵袭性的类型。替莫唑胺(temozolomide,TMZ)是一种通过DNA甲基化发挥抗肿瘤作用的烷基化药物,是治疗胶质瘤的标准药物。根据异柠檬酸脱氢酶(IDH)突变的情况,胶质瘤主要分为野生型(Wt)和突变型IDH组,与野生型(Wt)IDH瘤相比,IDH突变型胶质瘤患者的临床预后更好。
在过去的几十年里,许多研究集中在人类癌症中糖酵解或低氧代谢环境的增加,体内外证据表明,糖基化改变是癌细胞的普遍特征,某些多糖是各种类型肿瘤的众所周知的生物标记物。基于高糖能量需求有利于胶质瘤干细胞(GSC)存活的证据,与GSC相关的靶向糖基化过程是未来胶质瘤有吸引力的治疗策略。
图片来源: https://doi.org/10.1038/s41418-022-00969-2
近日,中国科学院云南省动物模型与发病机制重点实验室研究人员在Cell Death
& Differentiation杂志上发表了题为“Hypoxia-induced GLT8D1
promotes glioma stem cell maintenance by inhibiting CD133 degradation through N-linked
glycosylation”的文章。该研究发现为缺氧如何促进GLT8D1/CD133/Wnt/β-catenin信号转导在胶质瘤进展中的机制提供了见解,并确定了糖基转移酶8结构域1(GLT8D1)作为未来潜在的治疗靶点。
在这里,研究者报告了在低氧生态位下由缺氧诱导因子-1α诱导的包含1的糖基转移酶8结构域(GLT8D1)与胶质瘤的较高级别和较差的临床结果显著相关。GLT8D1的缺失在体外抑制了胶质瘤干细胞(GSC)的自我更新,并抑制了胶质瘤小鼠模型中的肿瘤生长。GLT8D1基因敲除促进细胞周期停滞于G2/M期,并促进细胞在TMZ处理或不处理的情况下发生凋亡。
研究者发现GLT8D1通过N-连接的糖基化和蛋白质-蛋白质相互作用,通过内体-溶酶体途径抑制CD133(肿瘤干细胞标志物)的降解。研究者还证实了CD133N1~108直接阻断GLT8D1/CD133复合体的形成,或乐卡地平抑制GLT8D1/FECD133的表达,均可抑制Wnt/β-catenin信号依赖性肿瘤的发生。
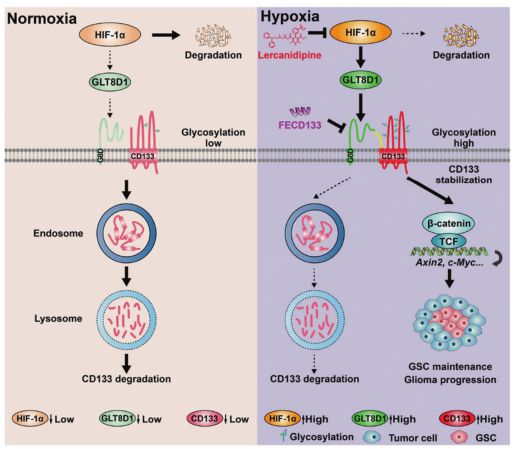
GLT8D1在胶质瘤进展过程中作用机制的研究
图片来源: https://doi.org/10.1038/s41418-022-00969-2
在本研究中,研究者发现低氧或低氧诱导的肿瘤细胞和组织中GLT8D1mRNA的上调与胶质瘤中更具侵袭性的疾病有关。该研究支持GLT8D1作为一种潜在的新的胶质瘤治疗靶点,它的快速临床翻译将对未来的患者具有重要意义。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。



