JCI:科学家有望基于自然杀伤性细胞来开发新型的人类癌症疗法
来源:生物谷原创 2022-11-25 11:06
来自阿尔伯特-爱因斯坦医学院等机构的科学家们通过研究描述了他们的最新研究发现,研究人员或有望增强免疫检查点疗法的疗效。
诸如派姆单抗(Keytruda)和纳武单抗(Opdivo)等免疫检查点抑制剂能通过释放机体免疫系统的T细胞来攻击肿瘤细胞,从而发挥功能,这一疗法在10年前的问世标志着癌症疗法的重大进步,然而仅有10%-30%接受治疗的患者会得到长期的疾病改善;近日,一篇发表在国际杂志Journal of Clinical Investigation上题为“Blockade of the immunosuppressive KIR2DL5/PVR pathway elicits potent human NK cell–mediated antitumor immunity”的研究报告中,来自阿尔伯特-爱因斯坦医学院等机构的科学家们通过研究描述了他们的最新研究发现,研究人员或有望增强免疫检查点疗法的疗效。
研究人员并没有召集T细胞来抵御癌症,而是利用名为自然杀伤性细胞(NK细胞)的不同人类免疫细胞来进行研究,他们观察到了戏剧性的研究结果。研究者Xingxing Zang博士说道,我们相信我们所开发的新型免疫疗法具有很大的潜力能进入到涉及多种类型癌症的临床试验中;免疫细胞表面布满了名为检查点蛋白的受体,其能防止免疫细胞偏离其通常的靶点(病原体感染细胞和癌细胞)。当免疫细胞上的检查点受体与机体自身正常细胞所表达的蛋白相结合时,这种相互作用就会对可能的免疫细胞攻击进行制动,然而大多数类型的癌细胞都会表达结合检查点蛋白的蛋白质,从而就会诱骗免疫细胞让其停止下来不再攻击肿瘤。
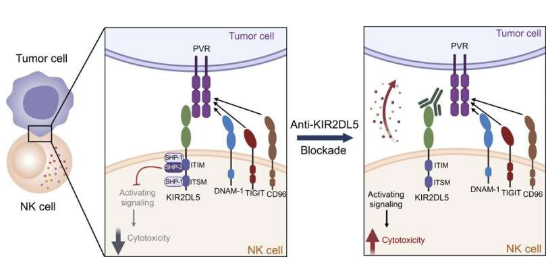
免疫检查点抑制剂就是一种单克隆抗体,其能通过阻断肿瘤蛋白或与肿瘤蛋白相结合的免疫细胞受体,从而来缩短免疫细胞/癌细胞之间的相互作用,由于没有制动器来阻碍这一过程,免疫细胞就能攻击并破坏癌细胞了。检查点抑制剂的有限的有效性就让研究人员开始观察涉及NK细胞的检查点途径,与T细胞一样,NK细胞在消除不需要的细胞方面扮演着重要角色,一种名为PVR的癌细胞蛋白很快就引起了他们的注意,于是研究人员就意识到,PVR或许能作为一种重要的蛋白质,被人类癌症用来阻碍免疫系统的攻击作用。PVR蛋白在正常组织通常不存在或含量很少,但在多种肿瘤中却丰度较高,包括结直肠癌、卵巢癌和肺癌等。此外,PVRs似乎还能通过结合名为TIGIT的检查点蛋白来抑制T细胞和NK细胞的活性,这或许就会促使科学家们通过利用抵御TIGIT的单克隆抗体来中断TIGIT/PVR通路,目前在全球有超过100项靶向作用TIGIT的临床试验正在进行中,然而,包括两个大型3期临床试验在内的多项临床研究最近发现并不能改善癌症患者的预后。
科学家有望基于自然杀伤性细胞来开发新型的人类癌症疗法。
图片来源:Journal of Clinical Investigation (2022). DOI:10.1172/JCI163620
与此同时,癌细胞蛋白PVR被发现在NK细胞上还有另一个结合伙伴—KIR2DL5,于是研究人员假设,PVR并不是通过结合TIGIT,而是通过结合最近识别的KIR2DL5分子来抑制NK细胞的活性,为了找到答案,研究人员合成了一种能靶向作用KIR2DL5的单克隆抗体,并利用抗体进行了体外和体内实验。在这项研究中,研究者Zang表示,KIR2DL5或许是人类NK细胞表面一种普遍存在的检查点受体,而PVR癌症蛋白则能利用该受体来抑制机体的免疫攻击。
在对携带多种人类癌症的人源化动物模型进行相关的研究后,研究者表示,能针对KIR2DL5的单克隆抗体或能通过阻断KIR2DL5/PVR途径,来促使NK细胞大力攻击并缩小人类肿瘤,从而延长动物的生存期;这些临床前的研究提高了研究人员的研究动力,即靶向作用KIR2DL5/PVR途径或许就是一个好主意,而且研究人员所开发的单克隆抗体也是一种有效的免疫疗法。目前研究人员已经提交了包括抗体药物在内的KIR2DL5/PVR免疫检查点的专利申请,同时他们对进一步开发和将该技术商业化非常感兴趣,研究者Zang此前已经开发了超过10种免疫检查点抑制剂并申请了相关专利;其中一种抑制剂目前正在中国进行2期临床试验,涉及数百名患晚期实体瘤的患者。
综上,本文研究结果揭示了KIR2DL5所介导的NK细胞免疫逃逸的功能性机制,并证明了阻断KIR2DL5/PVR轴或许能作为治疗人类癌症的疗法,同时研究人员还阐明了抗TIGIT疗法临床失败背后的原因及其分子机制。(生物谷Bioon.com)
原始出处:
Xiaoxin Ren,Mou Peng,Peng Xing, et al. Blockade of the immunosuppressive KIR2DL5/PVR pathway elicits potent human NK cell–mediated antitumor immunity, Journal of Clinical Investigation (2022). DOI: 10.1172/JCI163620
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


