胚胎红细胞生成和衰老与铁死亡有关
来源:本站原创 2021-11-18 14:17
铁死亡是一种调控的细胞坏死形式,是铁(II)依赖的脂质过氧化的结果。虽然铁死亡与癌细胞死亡、神经退行性变和再灌注损伤有关,但由于缺乏适当的方法,迄今为止铁死亡的生理作用尚未阐明。
铁死亡是一种调控的细胞坏死形式,是铁(II)依赖的脂质过氧化的结果。虽然铁死亡与癌细胞死亡、神经退行性变和再灌注损伤有关,但由于缺乏适当的方法,迄今为止铁死亡的生理作用尚未阐明。在这里,作者表明,通过HNEJ-1小鼠单克隆抗体检测到的4-羟基-2-壬烯醛(HNE)修饰蛋白是一种强有力的免疫组化技术,可根据各种铁死亡模型结合形态学核信息定位组织中的铁死亡
,包括依拉汀诱导的半胱氨酸剥夺、条件性 Gpx4 敲除和 Fe(II) 依赖性肾小管损伤,以及其他类型的受调节细胞死亡。
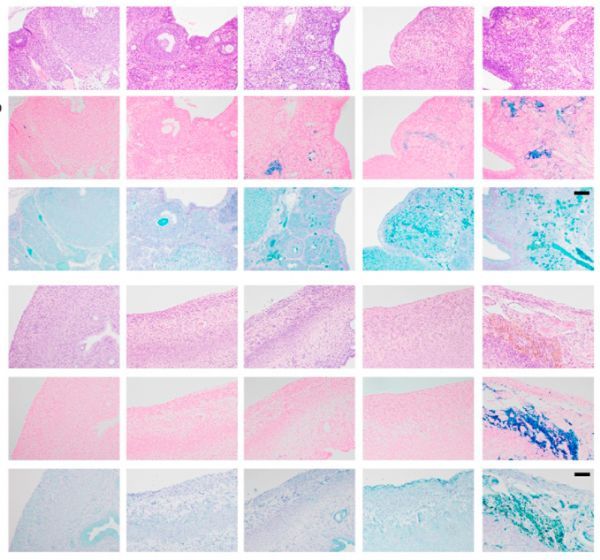
在铁(II)依赖的肾小管损伤模型中,通过对HNEJ-1修饰蛋白的非选择性鉴定,证实了HNEJ-1与铁死亡的特异性。作者进一步全面搜索了 Fischer-344 大鼠从 E9.5 到 2.5 岁不同发育阶段的铁死亡迹象。作者观察到肾、脾、肝、卵巢、子宫、小脑和骨髓的铁死亡有明显的年龄依赖性增加,并伴有铁的积累。
不仅吞噬细胞受到影响,实质细胞也受到影响。高脂肪或碳水化合物限制饮食显著促进衰老SAMP8小鼠表皮铁死亡。在fisher -344大鼠胚胎发生过程中,作者发现有核红细胞在E13.5处有铁死亡,在E18.5处无死亡。给予铁死亡抑制剂利蒲他汀-1可明显延迟红细胞去核。因此,该研究结果首次证明了铁死亡参与生理过程,如胚胎红细胞生成和衰老,分别提示了进化获得的机制和不可避免的副作用。
图片来源:https://doi.org/10.1016/j.redox.2021.102175
Ferroptosis 是铁依赖性脂质过氧化导致的一种受调节的细胞坏死,在用erastin 耗尽半胱氨酸后首次报道了H-ras 突变的纤维肉瘤细胞。目前对这一现象的解释是,细胞内催化铁(II)比抗氧化巯基更倾向于向铁死亡转变。这一新定义的细胞死亡引起了各个领域的研究兴趣,导致了对病理学的重新认识,不仅在癌症,而且在神经退行性疾病和再灌注损伤。
据报道,铁死亡抑制剂在神经退行性疾病的临床前模型中具有保护作用,包括帕金森病、亨廷顿病和阿尔茨海默病。癌变现在被认为是通过获得体细胞突变而获得耐铁的过程。值得注意的是,许多耐药和侵袭性癌细胞可能依赖于对铁死亡的抑制来生长和生存,这可能代表了这类癌症治疗的脆弱性。Ferroptosis也与肠缺血-再灌注损伤相关,ACSL4的激活在这一致死过程中发挥了关键作用。
一些分子的过表达被认为是铁死亡的一个生物标志物。例如,ACSL4在提高磷脂中多不饱和脂肪酸含量方面的作用被认为是铁死亡的潜在生物标志物和驱动因素。前列腺素内过氧化物合酶2 (PTGS2)是一种编码环氧合酶-2 (COX-2)的基因,已被描述在被铁死亡诱导物处理的细胞中增加。然而,由于缺乏易于操作和可靠的方法和工具来直接监测铁死亡的生理和病理生理学背景,到目前为止,铁死亡的生理学意义可能还没有确定。
HNEJ-1作为检测卵巢和子宫生理性下垂的铁死亡标志物
图片来源:https://doi.org/10.1016/j.redox.2021.102175
在这里,作者开始寻找一个合适的策略来发现生理上的铁死亡。如果设计一种合适的抗体来检测由不同机制引起的铁死亡,则对实验鼠的病理学分析可提供最佳的铁死亡筛查。一种铁螯合物,氮三乙酸铁(Fe-NTA)腹腔注射时,通过芬顿反应特异性地诱导肾近端小管的铁松脱,导致反复注射后鼠肾细胞癌的高发生率。
事实上,过量的铁与致癌有关。作者之前使用fe - nta诱导的氧化肾小管铁下死亡模型发现,4-羟基-2-壬烯醛(HNE)是脂质过氧化产物中最敏感的标记物。在此基础上,作者开发了5种不同的单克隆抗体,以对抗hne修饰蛋白中Michael加合物的半缩醛结构。作者从重新评估这些抗体开始,发现 HNEJ-1 是监测组织和蛋白质分离物中铁死亡事件的最有希望的候选者。(生物谷
Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。