Science:首次解析出伴肌动蛋白的三维结构图
来源:本站原创 2022-02-21 19:06
在一项新的研究中,来自德国马克斯-普朗克分子生理学研究所的研究人员使用前沿的电镜技术获得了首个高分辨率的伴肌动蛋白三维图片,其中伴肌动蛋白是一种巨大的肌动蛋白结合蛋白,是骨骼肌的重要组成部分。
2022年2月21日讯/生物谷BIOON/---心肌和骨骼肌作为可靠的生物机器的功能,归功于它们最小的收缩结构---肌节(sarcomere)---的非凡精确的组装。这些肌肉产生将血液输送到所有器官的能量,并使身体运动---从呼吸到短跑---需要数百万个蛋白组分的协调组装,这些蛋白组分是由人体最大的蛋白--肌联蛋白(titin)、伴肌动蛋白(nebulin)和遮蔽蛋白(obscurin)---协调的。
由于其巨大的尺寸,研究这些蛋白充满了技术挑战。在一项新的研究中,来自德国马克斯-普朗克分子生理学研究所的研究人员使用前沿的电镜技术获得了首个高分辨率的伴肌动蛋白三维图片,其中伴肌动蛋白是一种巨大的肌动蛋白结合蛋白,是骨骼肌的重要组成部分。这一发现使我们有机会更好地了解伴肌动蛋白的作用,因为它的尺寸很大,而且很难从肌肉中提取出天然状态的伴肌动蛋白,这就使得它的功能一直很模糊。相关研究结果发表在2022年2月18日的Science期刊上,论文标题为“Structures from intact myofibrils reveal mechanism of thin filament regulation through nebulin”。
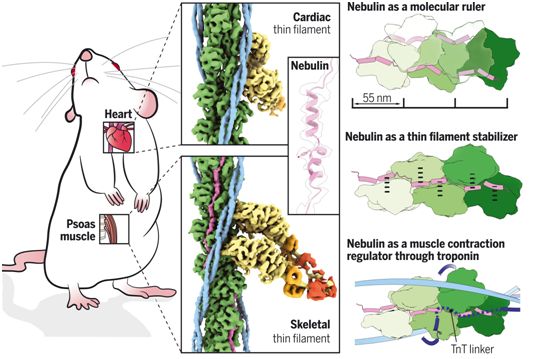
小鼠骨骼肌细丝表面上的伴肌动蛋白的原位结构。图片来自Science, 2022, doi:10.1126/science.abn1934。
这些作者利用低温电子断层扫描术(cryo-ET)解析出伴肌动蛋白的结构,细节令人印象深刻。他们的发现可能会带来治疗肌肉疾病的新方法,因为伴肌动蛋白的基因突变伴随着肌肉力量的急剧下降,这被称为线状体肌病(nemaline myopathy)。
当平行的肌球蛋白和肌动蛋白丝滑动时,心肌和骨骼肌收缩和放松。作为另一种细长的蛋白,伴肌动蛋白只存在于骨骼肌中,它与肌动蛋白配对,通过一系列串联在一起的称为重复序列的类似结构来稳定和调节它。编码伴肌动蛋白的基因突变可产生异常的伴肌动蛋白,导致线状体肌病。线状体肌病是一种无法治愈的神经肌肉疾病,有不同程度的严重性,从肌肉无力到语言障碍和呼吸问题。
了解伴肌动蛋白的结构以及它究竟如何与肌动蛋白相互作用,对开发新的治疗方法可能是至关重要的。在这项研究中,这些作者通过使用cryo-ET,能够直接观察到肌肉中的肌球蛋白和肌动蛋白。这些实验是在与人类非常相似的小鼠肌肉上进行的。引人注目的是,心肌肌动蛋白丝显示出明显缺乏伴肌动蛋白。
这些研究结果显示,每个伴肌动蛋白重复序列都与一个肌动蛋白亚基结合,表明伴肌动蛋白的作用是作为一把尺子,将肌动蛋白丝的长度分级。每个伴肌动蛋白重复序列与每个相邻的肌动蛋白亚基相互作用,这解释了它作为稳定器的作用。最后,这些作者提出,伴肌动蛋白可以通过与另一种叫做肌钙蛋白(troponin)的蛋白相互作用来调节肌动蛋白和肌球蛋白的结合,从而调节肌肉的收缩。
这些作者如今将集中精力揭开肌球蛋白调节的结构细节。这些发现最终可能有助于全面描绘出骨骼肌和心肌收缩背后的复杂细节。(生物谷 Bioon.com)
参考资料:
Zhexin Wang et al. Structures from intact myofibrils reveal mechanism of thin filament regulation through nebulin. Science, 2022, doi:10.1126/science.abn1934.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


