可别太瘦,身上攒点肉还是有好处的!最新Nature子刊:改变脂肪的代谢途径后,其能和肿瘤细胞竞争营养物质,抑制肿瘤生长
来源:生物谷原创 2025-03-04 09:41
谁说那肥肉没有用呢?它可能是我们对抗疾病的秘密武器呢!
如果说能用你身上的一样东西换一个愿望,你会选择什么?小编先来,“信女愿用身上的十斤肥肉换暴富!”
玩笑归玩笑,但当我们谈论脂肪时,很多人第一时间想到的可能就是肥胖、高血脂、高血压等健康问题。在大多数人的观念中,脂肪无疑是个“反派角色”,试问,谁不想脂肪越少越好呢?然而,事实并非如此简单。脂肪不仅是能量储存的重要方式,还对保护器官和维持身体正常功能起着至关重要的作用。
实际上,脂肪的功能远不止于此。Hai P. Nguyen及其团队的最新研究为脂肪细胞赋予了新的使命——通过基因工程改造脂肪细胞,使其能够与肿瘤细胞竞争有限的营养物质,从而抑制肿瘤生长。这种策略被称为脂肪操纵移植(AMT)。这一发现不仅颠覆了我们对脂肪的传统认知,也为我们对抗癌症提供了全新的视角。

研究背景以及实验设计
癌症,作为现代医学面临的重大挑战之一,其恐怖之处在于癌细胞强大的生长代谢能力。无论是在有氧还是无氧条件下,癌细胞都能高效利用脂肪酸和葡萄糖来支持其快速增殖和存活。
本项研究中,研究人员就巧妙地利用这一点,通过CRISPRa技术对脂肪细胞进行基因改造,增强了它们对营养物质(如葡萄糖和脂肪酸)的摄取能力,以此抑制肿瘤的生长。
研究人员还培养了三维(3D)脂肪组织类器官,并将经过CRISPRa修饰的脂肪细胞或脂肪组织类器官与多种癌细胞系(包括乳腺癌、结肠癌、胰腺癌和前列腺癌)共培养。这就好比一场“营养争夺战”,观察癌细胞在面对改良后的脂肪细胞时,其增殖情况以及葡萄糖摄取、糖酵解和脂肪酸氧化(FAO)能力的变化。最后,这些改良后的脂肪组织类器官被与癌细胞异种移植瘤共同植入免疫缺陷小鼠体内,评估其对肿瘤生长的具体影响。
脂肪细胞的超级变身——白变棕
首先,研究人员利用CRISPRa技术,成功将普通的白色脂肪细胞摇身一变为“具有棕色脂肪特性的”细胞。这一过程显著提升了新诱导脂肪细胞中的UCP1、PPARGC1A和PRDM16基因的mRNA水平。同时,其他几个标志性的棕色脂肪基因(如TFAM、DIO2、CPT1b和NRF1)的表达也显著增加,这表明这些脂肪细胞已经成功转变为棕色脂肪细胞。
为了验证这些变化是否带来了实际的代谢改进,研究人员测量了氧气消耗率(OCR)。结果显示,在基础和最大呼吸能力下,经过CRISPRa处理的脂肪细胞的OCR显著增加,显示出它们具备了典型的棕色脂肪细胞的高代谢特性。这意味着这些细胞不仅能够更有效地消耗氧气,还能在能量消耗方面表现出更高的效率。
此外,这些改造后的脂肪细胞在基础条件和胰岛素刺激下的葡萄糖摄取能力也得到了显著增强,就像给细胞装上了一个“超级吸收器”,使其能更高效地利用葡萄糖作为能量来源。而在脂肪酸氧化能力测试中,当这些细胞被置于含有BSA结合棕榈酸的培养基中时,它们的OCR值同样显著升高,表明其脂肪酸氧化能力也得到了加强。
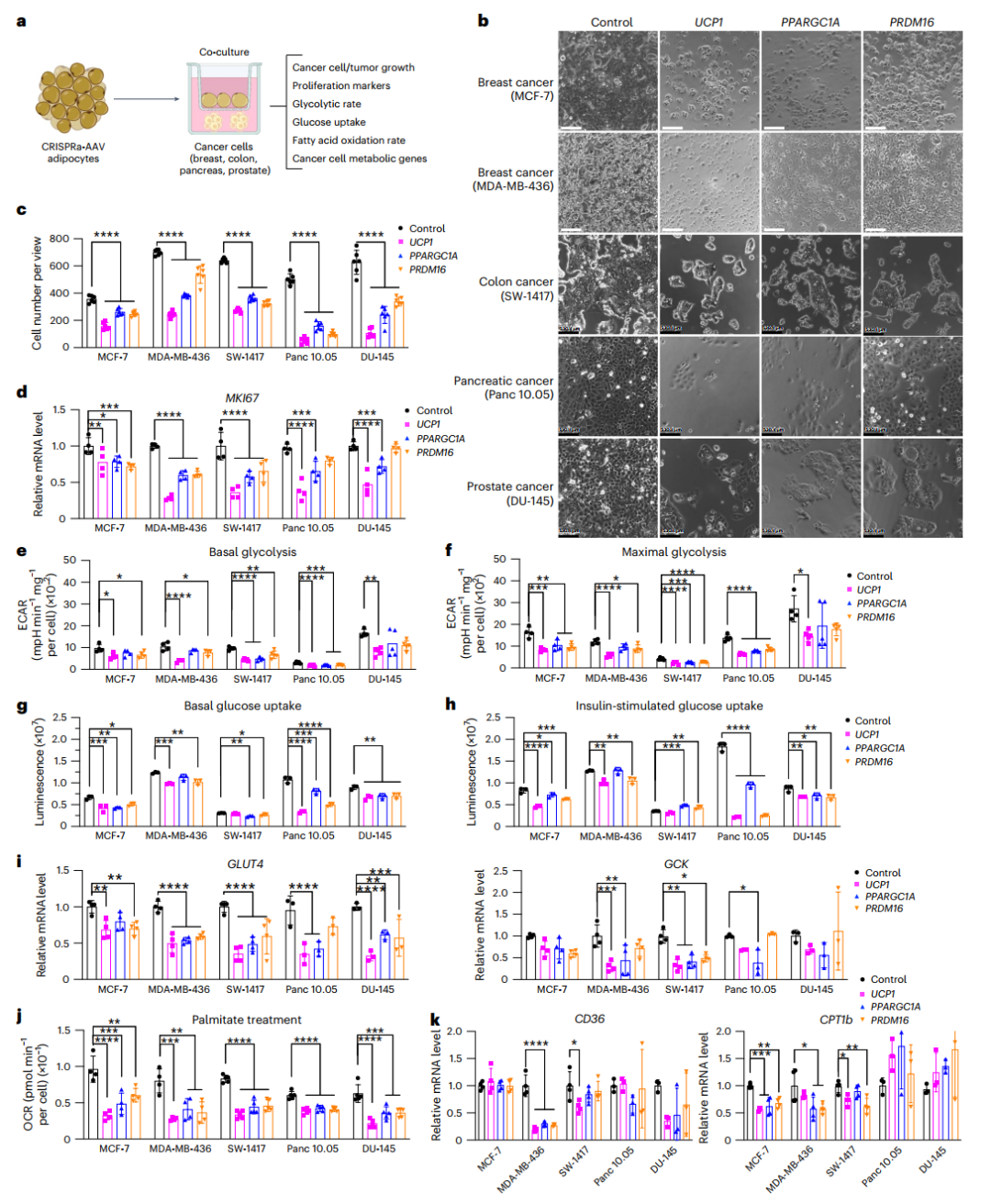
图1. CRISPRa调控的脂肪细胞体外抑制癌细胞生长
脂肪细胞2.0:走癌细胞的路,让癌细胞无路可走
接下来,研究人员将经过CRISPRa技术修饰的脂肪细胞与五种不同的癌细胞系(包括乳腺癌、结肠癌、胰腺癌和前列腺癌)共同培养。结果非常显著:所有癌细胞的数量都明显减少了。
为了进一步了解这一现象,研究人员使用qRT-PCR技术检测了这些癌细胞中的增殖标志基因MKI67的表达水平。结果显示,与经过CRISPRa修饰的脂肪细胞共培养的癌细胞中,MKI67基因的表达显著降低,表明癌细胞的增殖能力被有效抑制。
此外,研究人员还测量了癌细胞的糖酵解速率。令人惊讶的是,在基础和最大糖酵解速率下,大多数癌细胞系的糖酵解速率都显著下降。通过qRT-PCR分析发现,关键糖酵解基因(如GCK和GLUT4)的表达也显著减少,这进一步证实了癌细胞的代谢功能受到了抑制。
在脂肪酸氧化(FAO)能力测试中,当癌细胞在含有BSA结合棕榈酸的培养基中培养时,它们的氧气消耗率(OCR)显著降低,表明其脂肪酸氧化能力减弱。进一步的qRT-PCR分析也显示,癌细胞中脂肪酸转运蛋白CD36和FAO关键调节因子CPT1b的表达也显著下降。
以上这些实验结果表明,经过CRISPRa技术修饰的升级版脂肪细胞能够通过抑制癌细胞的代谢功能来有效抑制其生长!
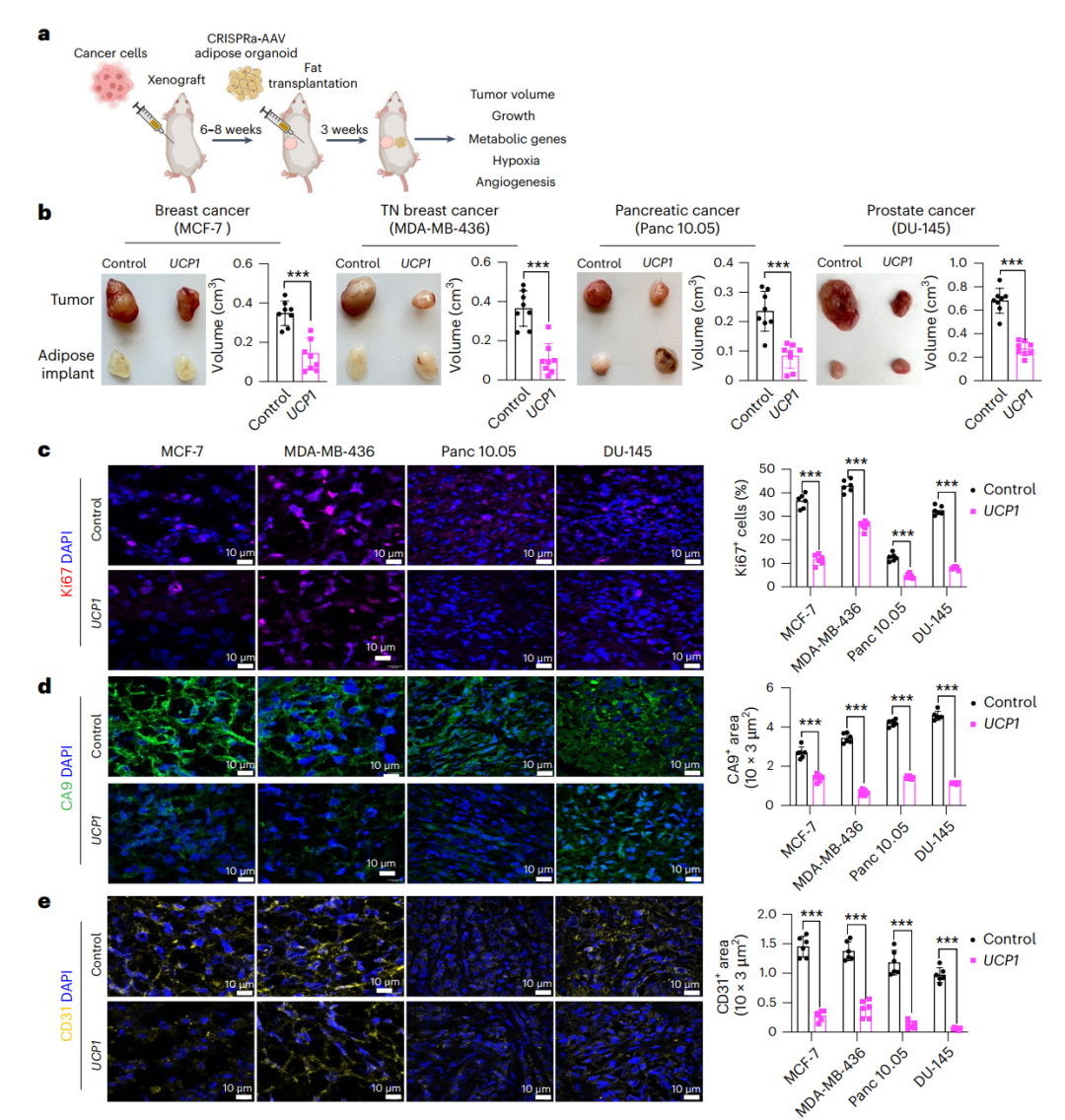
图2. 与UCP1-CRISPRa修饰的人类脂肪组织类器官共移植抑制肿瘤生长
为了进一步验证CRISPRa修饰的脂肪组织类器官在体内的有效性,研究人员将这些改良后的脂肪组织与四种癌细胞系共同移植到免疫缺陷小鼠体内。结果显示,所有肿瘤体积显著减小,且肿瘤中增殖标志基因MKI67的表达也明显降低,这表明肿瘤的增殖能力被显著抑制!
不仅如此,研究还发现,肿瘤中的缺氧和血管生成减少,葡萄糖和脂肪酸水平也显著降低。这些结果表明,经过CRISPRa修饰的脂肪组织类器官不仅能有效抑制肿瘤生长,还能改善肿瘤微环境。
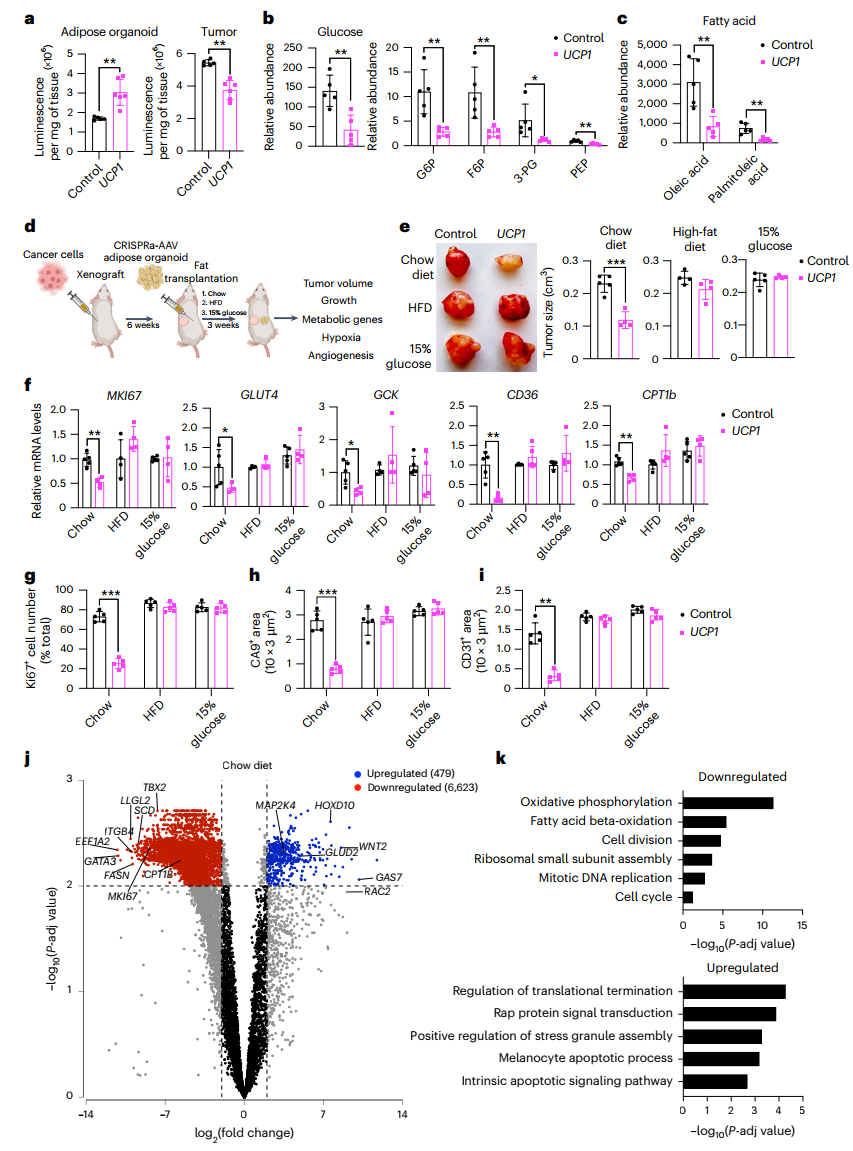
图3:增加营养物质可减少UCP1-CRISPRa人类脂肪组织类器官对癌症的抑制作用
研究人员还测量了全身代谢情况,发现植入CRISPRa修饰脂肪组织类器官的小鼠在各种温度下全身氧气消耗量均显著增加,同时它们表现出更好的葡萄糖耐量和胰岛素敏感性,胰岛素水平接近野生型SCID小鼠的水平。这说明CRISPRa修饰的脂肪细胞能够改善整体代谢状态。
在营养竞争实验中,当小鼠食用标准饮食时,改造后的脂肪组织类器官能显著抑制肿瘤生长;然而,当小鼠食用高脂饮食或含15%葡萄糖的水时,这种抑制效果减弱。这表明,改造后的脂肪细胞通过与肿瘤细胞竞争有限的营养物质来发挥作用,而当营养充足时,这种竞争机制的效果会减弱。
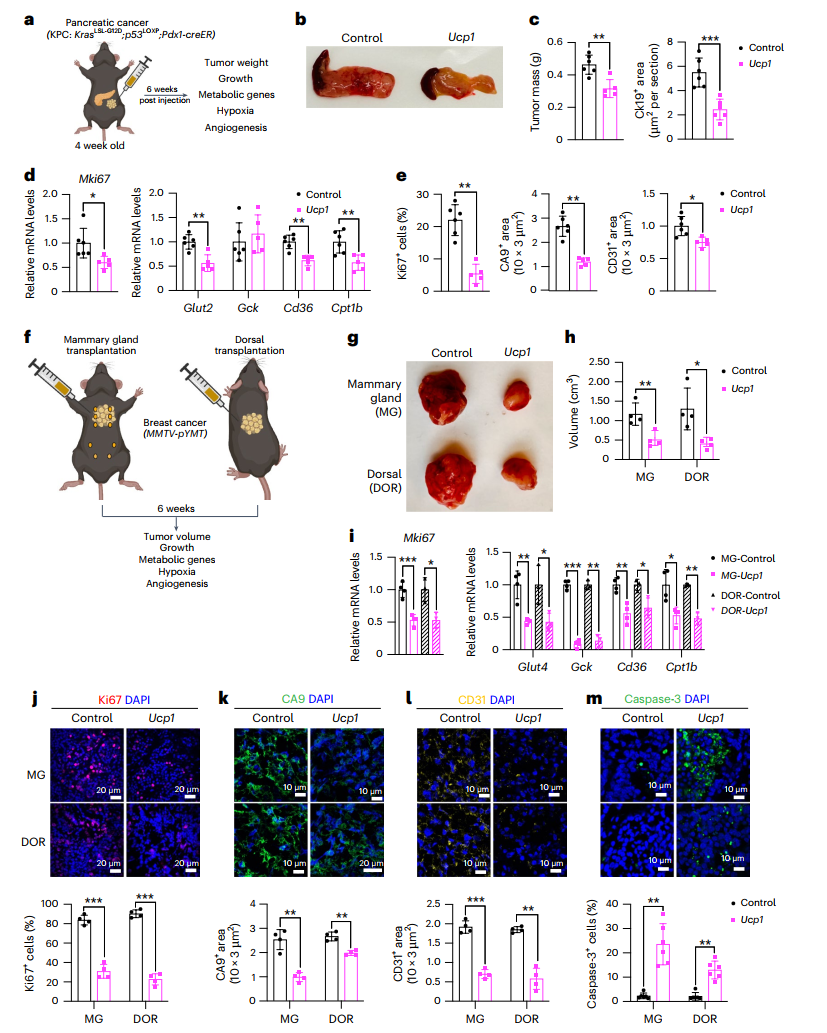
图4:UCP1-CRISPRa脂肪组织类器官在遗传癌症小鼠模型中抑制癌症发展
为进一步探索AMT技术在临床应用中的潜力,研究人员还在遗传癌症小鼠模型中进行了实验。在胰腺癌KPC小鼠模型中,植入Ucp1-CRISPRa修饰的脂肪组织类器官后,小鼠的肿瘤体积显著减小,胰腺质量也有所下降。类似地,在乳腺癌MMTV-PyMT小鼠模型中,无论将改造后的脂肪组织类器官植入乳腺附近还是远离肿瘤的位置,都能显著抑制肿瘤生长。这些结果表明,AMT技术不仅在异种移植模型中有效,还可能对遗传癌症模型产生系统性的治疗效果。
最后,研究人员展示了AMT技术的可定制性。例如,通过上调脂肪细胞中的UPP1基因,可以抑制依赖尿苷的胰腺导管腺癌的生长。这表明,AMT技术可以通过针对不同的代谢途径来治疗多种类型的癌症。
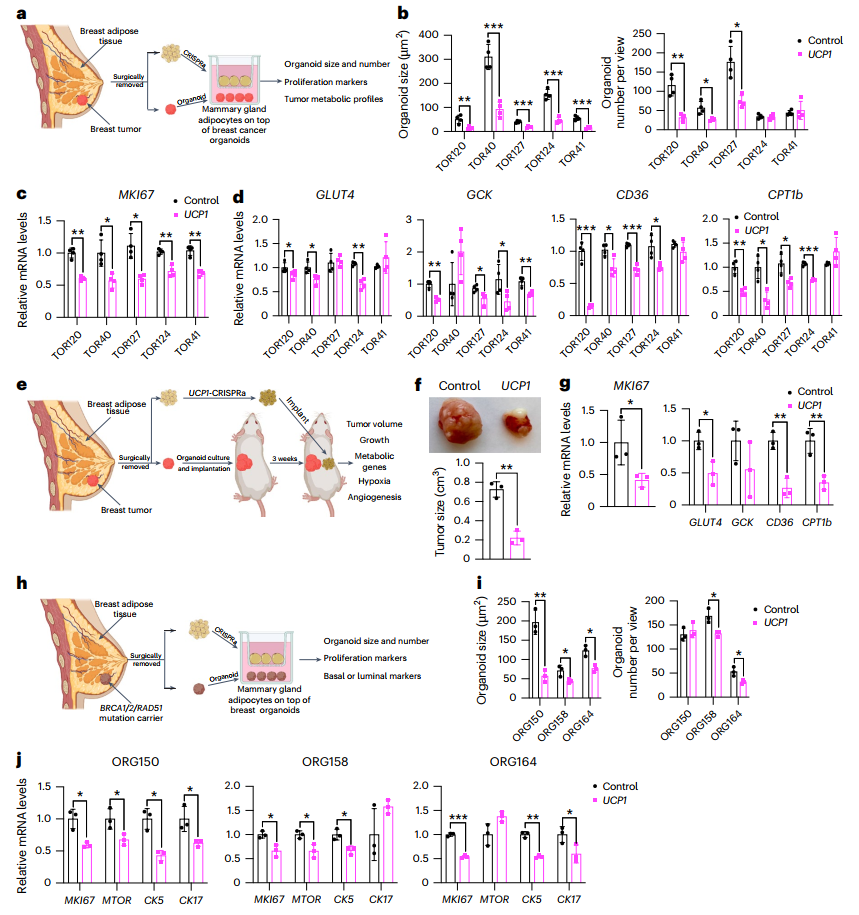
图5. 从切除的乳腺组织中分离的脂肪细胞经UCP1-CRISPRa处理后抑制肿瘤生长
小结
总的来说,本研究证实:CRISPRa技术改造的脂肪细胞能够通过竞争营养物质来抑制肿瘤的生长,并且这种技术在多种癌症模型中均显示出显著的效果。
AMT技术不仅在抑制肿瘤生长和进展方面具有巨大潜力,其可定制性和系统性治疗效果使其具备广泛的临床应用前景。或许在不久的将来,我们将不再谈癌色变,也会重新审视脂肪的价值。
谁说那肥肉没有用呢?它可能是我们对抗疾病的秘密武器呢!
参考文献:
Nguyen HP, An K, Ito Y, et al. Implantation of engineered adipocytes suppresses tumor progression in cancer models. Nat Biotechnol. Published online February 4, 2025. doi:10.1038/s41587-024-02551-2
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


