《癌细胞》:重大突破!吴一龙团队首次发现,放疗期间ctDNA持续阴性的肺癌患者或已实现临床治愈
来源:奇点糕 2023-10-11 09:39
吴一龙团队在著名期刊《癌细胞》上发表了一项重磅研究成果[1]。他们发现,
吴一龙团队在著名期刊《癌细胞》上发表了一项重磅研究成果[1]。他们发现,对于不可手术的局晚期非小细胞肺癌患者而言,利用ctDNA检测分子残留病灶(ctDNA-MRD)可以预测接受根治性放化疗患者的预后。
具体来说,他们首次证实,与基线相比,放疗中和放疗后的ctDNA浓度呈显著下降趋势。此外,对于放疗中和放疗后均检测不到ctDNA的患者而言,无论是使用还是不使用巩固免疫检查点抑制剂治疗,都有很好的预后。
更重要的是,他们还首次发现对于那些治疗过程中持续检测不到ctDNA的患者而言,他们可能实现了临床治愈,而这部分患者的占比高达20.1%。
这项研究成果意味着,ctDNA-MRD可以用于指导局晚期非小细胞肺癌患者的治疗,可以帮助部分患者免于过度治疗。

论文首页截图
近年来,基于ctDNA监测肺癌MRD的研究越来越多。
就在去年6月份,吴一龙团队在著名期刊Cancer Discovery上发表肺癌MRD研究的第一个重磅成果,首次发现对于接受根治手术治疗的I-III期非小细胞肺癌患者而言,术后ctDNA-MRD持续阴性就意味着实现了临床治愈[2]。
与可切除的早期肺癌类似,不可切除的局晚期肺癌领域也存在很多未满足的需求。其中最重要的一点是,已经有临床研究发现,单纯的根治性放化疗可以让大约20%左右的患者实现临床治愈[3-6];然而,这部分患者究竟是谁,有哪些特征,目前仍不清楚。
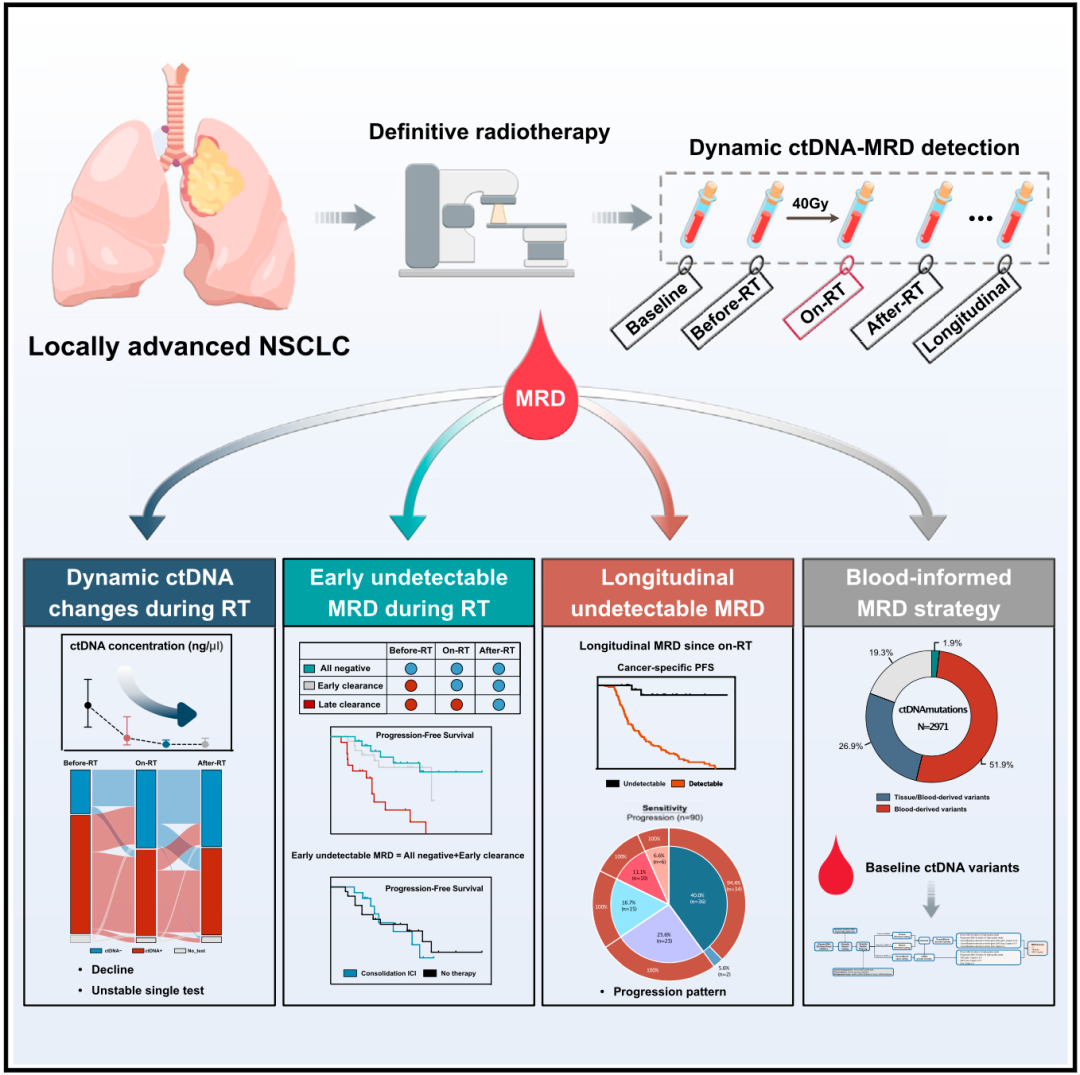
为了解决上述问题,吴一龙团队往前走了一步,发起了迄今规模最大的前瞻性研究,以探索ctDNA-MRD在不可切除局晚期非小细胞肺癌的根治性放化疗领域的价值。
这个研究一共招募了139名不可切除的局晚期非小细胞肺癌患者,患者的中位年龄为62岁(28-84岁)。所有患者都接受了根治性放射治疗(56-66Gy),其中58名患者(41.7%)在放疗后接受了免疫检查点抑制剂(50人)或靶向治疗(8人)作为巩固治疗。
在整个研究期间,研究人员一共分析了761份血液样本,采样时间分布在基线(治疗前,63.3%)、放疗前(放疗开始当天,95.7%)、放疗中(放疗达到40Gy,97.1%)、放疗后(放疗结束当天,96.4%)和后续随访期间(每3-6个月一次)。
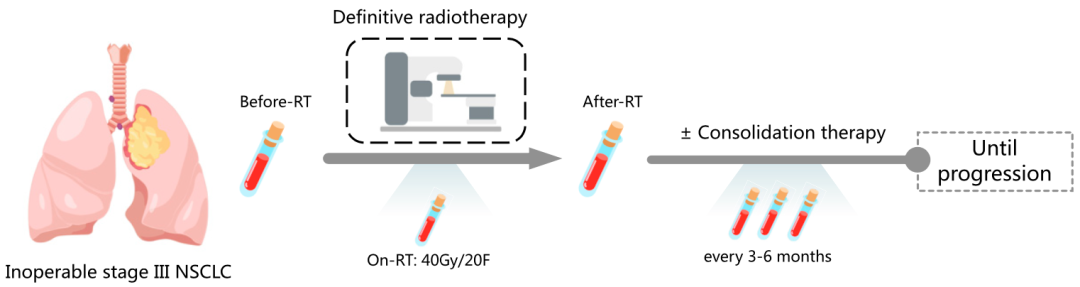
研究流程
总的来看,放疗前、放疗中和放疗后的ctDNA阳性检出率分别为72.9%、52.6%和53.0%。而且随着治疗的开展,ctDNA浓度呈下降趋势;不过,只有放疗中和放疗后这两个时间点的ctDNA浓度与基线相比有显著差异(p<0.001)。
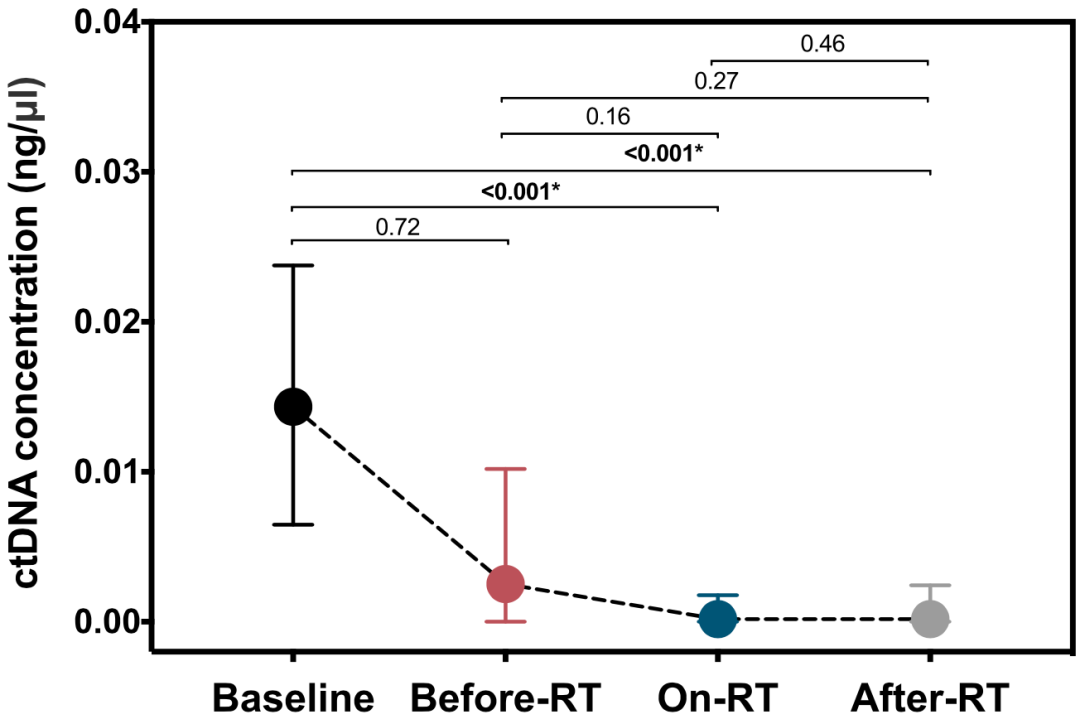
ctDNA浓度的变化趋势
在放疗后这个时间点,与能检测到MRD(ctDNA阳性)的患者相比,检测不到MRD(ctDNA阴性)的患者有更好的PFS。
在可检测到MRD的患者中,接受了巩固免疫检查点抑制剂治疗患者(28人,40.6%)的PFS,优于未接受患者(41人,P=0.013,HR=0.54)。相比之下,在未检测到MRD的人群中,接受巩固免疫检查点抑制剂治疗的患者(20人,35.1%)与未接受的患者(37人,64.9%)相比,PFS没有显著差异(p=0.304);两组的复发人数分别为9人(45.0%)和18人(48.6%)。
不难看出,MRD对于是否需要巩固免疫治疗有一定的预测价值。然而,在未检测到MRD的人群中,仍有近一半的患者出现癌症复发,这意味着单一时间点的ctDNA-MRD灵敏度确实还不够。
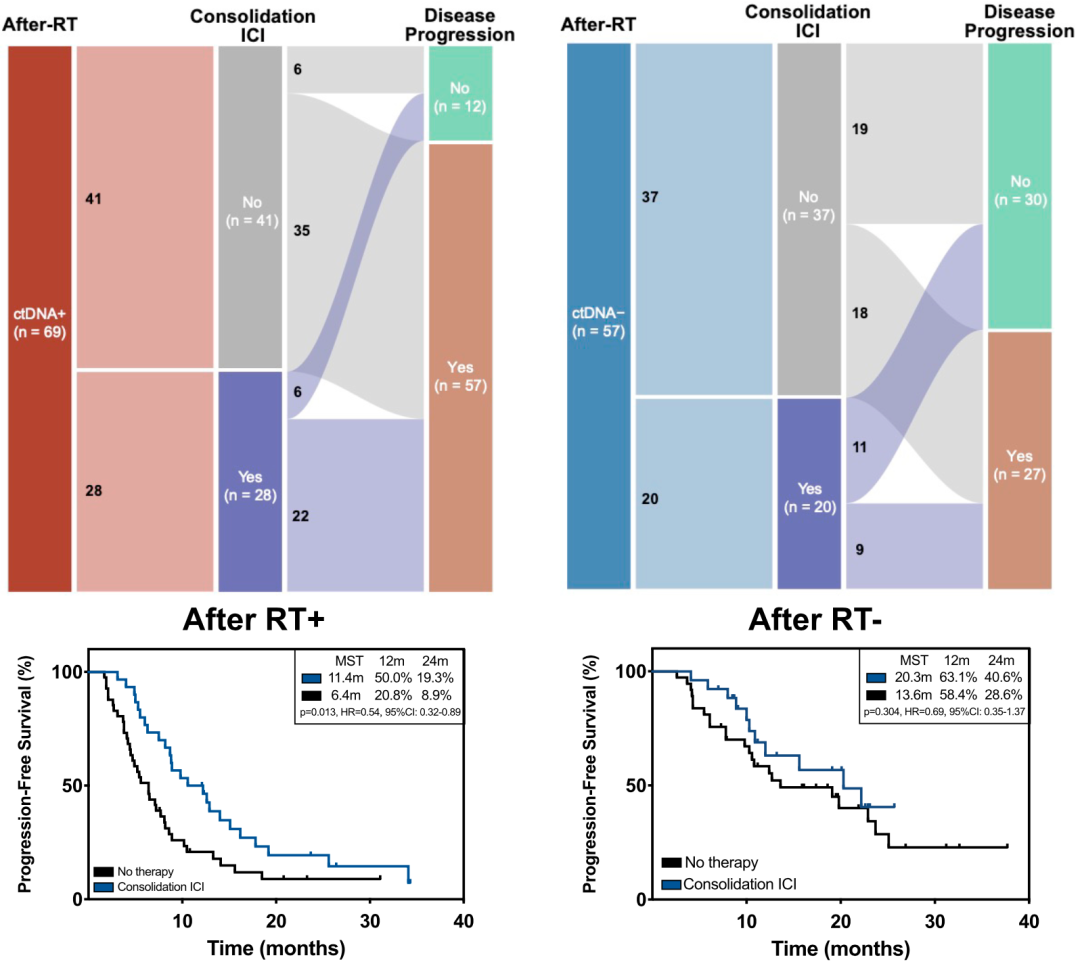
MRD检出状态与预后的关系
此时,吴一龙团队注意到,ctDNA其实在放疗中这个时间点就开始下降了,那么加入这个时间点后会不会有更大的优势呢?
于是,他们将放疗中和放疗后这两个时间点,ctDNA均为阴性的患者定义为“早期ctDNA清零”的患者。从数据来看,“早期ctDNA清零”的患者的PFS显著优于仅放疗后ctDNA清零的患者(22.9个月 vs. 10.3个月,HR=0.29,p<0.001)。而且ctDNA全阴性患者与“早期ctDNA清零”患者的生存率没有显著差异(p=0.478)。
此外,“早期ctDNA清零”患者也不能从巩固免疫检查点抑制剂治疗中获益(20.3个月 vs. 22.9个月,HR=0.95,p=0.917),两组的复发人数分别为6例(35.3%)和7例(33.3%)。这意味着“早期ctDNA清零”的患者放化疗效果更好,对这些患者进行巩固治疗的疗效有限。
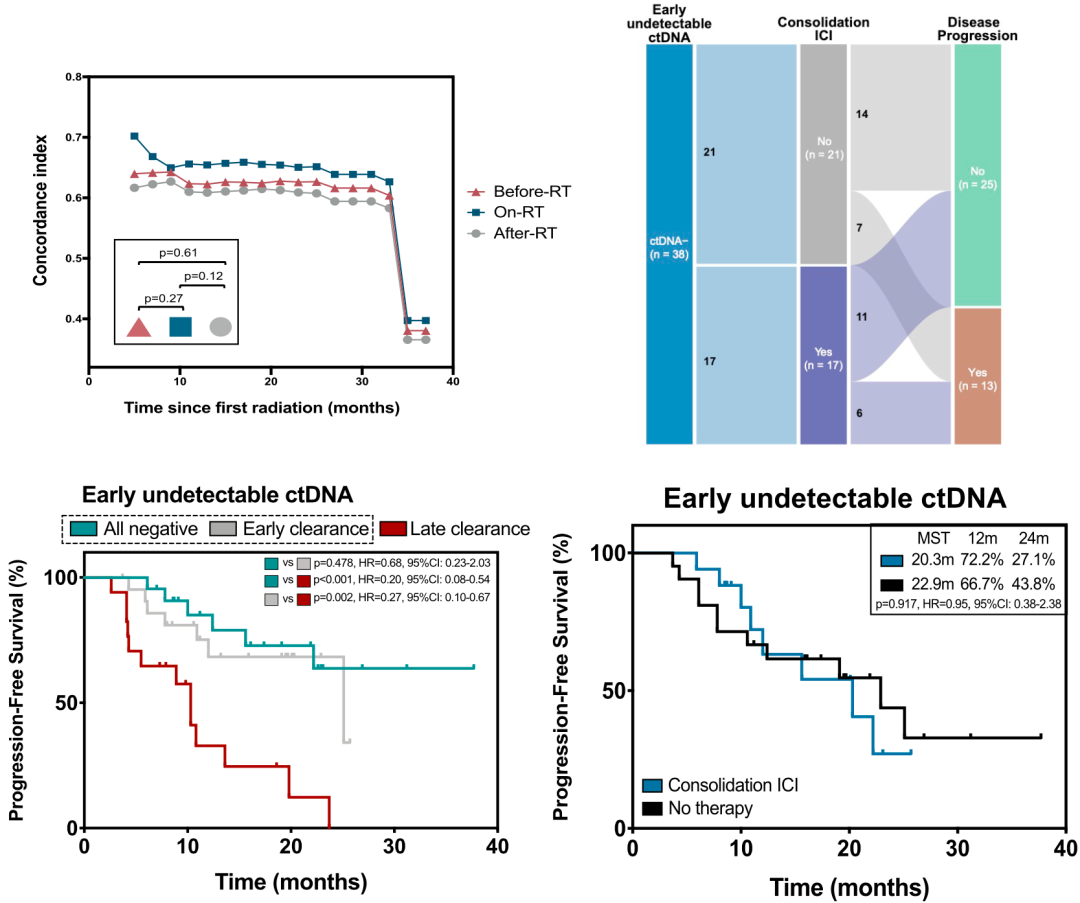
“早期ctDNA清零”的预后价值
接下来,吴一龙团队研究了持续监测ctDNA-MRD的价值。
正如他们所料,对于从放疗中开始持续检测不到ctDNA的那20.1%的患者而言(与之前的临床研究数据恰好吻合),他们的PFS显著更优(未达到 vs. 8.7个月,p<0.001,HR=0.18)。如果排除非癌症相关死亡的话,预后价值同样显著(未达到 vs. 8.8个月,p<0.001,HR=0.06)。
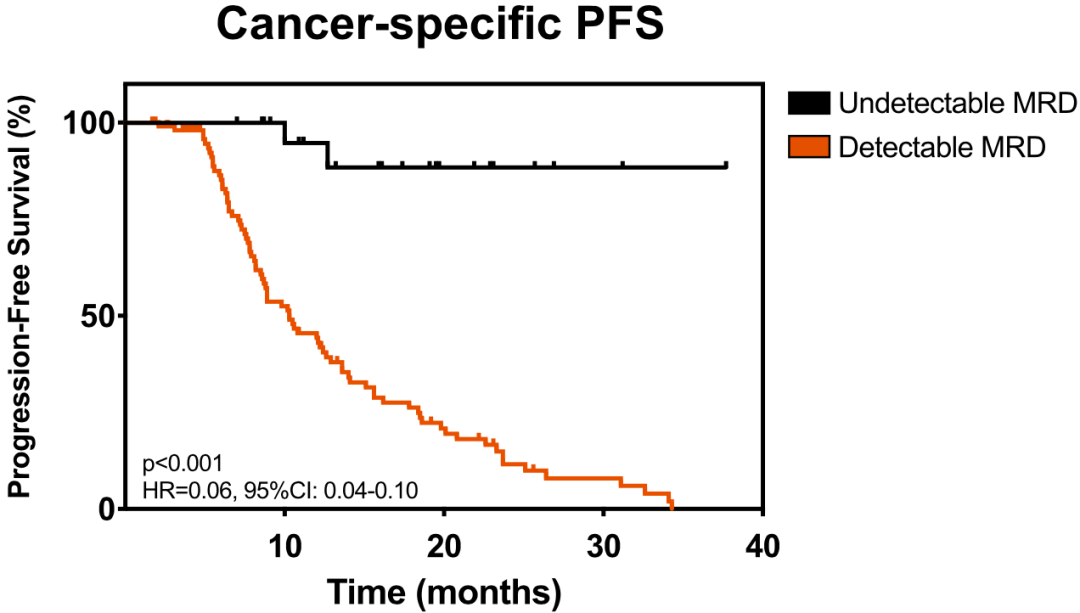
续检测不到ctDNA与预后的关系
鉴于持续检测不到ctDNA-MRD患者的1年和2年PFS率分别达到94.7%和88.4%,吴一龙团队认为,根治性放疗之后,持续检测不到ctDNA-MRD意味着潜在的临床治愈。
另外,值得一提的是,ctDNA-MRD预测的癌症进展要早于影像学,提前的中位时间是4个月。
在研究的最后,吴一龙团队还探讨了不可手术癌症患者MRD信息的来源问题,他们发现治疗前检测到的ctDNA变异是局晚期肺癌MRD信息来源的重要补充。
研究摘要图示
总的来说,吴一龙团队这项研究成果是不可手术局晚期肺癌治疗领域的一项重大突破,它不仅找到了巩固免疫治疗不能带来临床获益的患者群体,还首次定义了被根治性放疗治愈的20%患者,让局晚期肺癌的精准治疗迈上了新台阶。
无论如何,期待ctDNA-MRD早日落地临床,给患者带来实实在在的好处。
参考文献:
[1].Yi Pan, Jia-Tao Zhang, Xuan Gao, et al. Dynamic circulating tumor DNA during chemoradiotherapy predicts clinical outcomes for locally advanced non-small cell lung cancer patients. Cell, 2023. doi: 10.1016/j.ccell.2023.09.007
[2].Zhang JT, Liu SY, Gao W, et al. Longitudinal Undetectable Molecular Residual Disease Defines Potentially Cured Population in Localized Non-Small Cell Lung Cancer. Cancer Discov. 2022;12(7):1690-1701. doi:10.1158/2159-8290.CD-21-1486
[3].Antonia SJ, Villegas A, Daniel D, et al. Durvalumab after Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. N Engl J Med. 2017;377(20):1919-1929. doi:10.1056/NEJMoa1709937
[4].Spigel DR, Faivre-Finn C, Gray JE, et al. Five-Year Survival Outcomes From the PACIFIC Trial: Durvalumab After Chemoradiotherapy in Stage III Non-Small-Cell Lung Cancer. J Clin Oncol. 2022;40(12):1301-1311. doi:10.1200/JCO.21.01308
[5].Bradley JD, Paulus R, Komaki R, et al. Standard-dose versus high-dose conformal radiotherapy with concurrent and consolidation carboplatin plus paclitaxel with or without cetuximab for patients with stage IIIA or IIIB non-small-cell lung cancer (RTOG 0617): a randomised, two-by-two factorial phase 3 study. Lancet Oncol. 2015;16(2):187-199. doi:10.1016/S1470-2045(14)71207-0
[6].Bradley JD, Hu C, Komaki RR, et al. Long-Term Results of NRG Oncology RTOG 0617: Standard- Versus High-Dose Chemoradiotherapy With or Without Cetuximab for Unresectable Stage III Non-Small-Cell Lung Cancer. J Clin Oncol. 2020;38(7):706-714. doi:10.1200/JCO.19.01162
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


