Cell Stem Cell:发现肝脏胆汁酸代谢影响肠道屏障功能分子机制
来源:上海药物所 2022-09-09 11:40
肠上皮屏障损伤在炎症性肠病(IBD)细胞和分子发病机制研究中备受关注。肠上皮屏障结构和功能的完整性依赖稳定更新的上皮细胞和具有正常功能的细胞旁通路。胆汁酸是肝脏中胆固醇分解的最终产物,主要通过法尼
肠上皮屏障损伤在炎症性肠病(IBD)细胞和分子发病机制研究中备受关注。肠上皮屏障结构和功能的完整性依赖稳定更新的上皮细胞和具有正常功能的细胞旁通路。胆汁酸是肝脏中胆固醇分解的最终产物,主要通过法尼醇X受体(FXR)和G蛋白偶联胆汁酸受体1(TGR5)调节机体能量代谢和免疫功能等。已有研究表明,胆汁酸是肠上皮屏障功能的重要调控物质,但内在机制尚不清晰。
中国科学院上海药物研究所、上海中医药大学龙华医院与美国国立卫生研究院合作,在肠道上皮屏障修复的跨器官调控机制研究中取得重要进展。相关研究成果以Hepatic cytochrome P450 8B1 and cholic acid potentiate intestinal epithelial injury in colitis by suppressing intestinal stem cell renewal为题,在线发表在Cell Stem Cell上。
研究发现,活动期IBD患者和结肠炎小鼠体内胆汁酸代谢紊乱,胆酸(CA)水平显著上调,且肝脏胆汁酸经典合成途径代谢酶CYP8B1出现过度活化。外源补充CA或过表达CYP8B1均能够加重小鼠IBD表型、损伤肠道屏障及其修复功能,而干扰CYP8B1的表达则可促进肠道炎症缓解,恢复肠上皮再生能力。
隐窝肠道干细胞(Lgr5+ ISC)的自我更新在维持肠稳态、抵御微生物入侵中发挥重要作用。为剖析CYP8B1-CA代谢轴影响肠干细胞(ISC)更新的机制,研究分离结肠炎小鼠的肠道隐窝和ISC进行体外培养,发现病理浓度的CA显著减弱结肠炎小鼠隐窝中类器官的出芽和传代能力,并直接抑制Lgr5+ ISC的增殖(图1)。
进一步的RNA-Seq和代谢组学分析中发现,CA可抑制结肠炎小鼠隐窝的脂肪酸氧化(FAO)过程及PPARα信号通路。研究通过肠特异性敲除Pparα的结肠炎小鼠证实了CYP8B1-CA代谢轴通过抑制PPARα介导的FAO,削弱Lgr5+ ISC的更新能力,加重肠道屏障损伤。研究应用FXR激动剂奥贝胆酸(OCA)间接抑制结肠炎小鼠体内CYP8B1的活性,可促进其Lgr5+ ISC的增殖和传代能力,验证了肝脏FXR-CYP8B1-CA代谢轴在IBD中的重要作用。
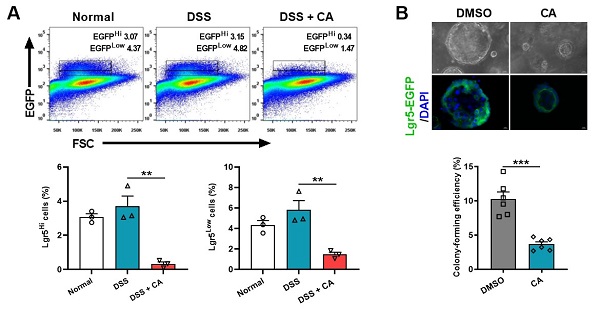
图1.CA直接抑制Lgr5+ ISC的增殖
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


