Molecular Cancer | 迈向癌症治疗新纪元:CAR-M疗法的临床潜力
来源:生物探索 2024-06-05 09:33
近年来,嵌合抗原受体(Chimeric Antigen Receptor, CAR)技术在癌症治疗领域取得了突破性进展,尤其是在血液肿瘤的治疗中。
近年来,嵌合抗原受体(CAR)技术在血液肿瘤治疗中取得了显著进展,特别是在急性淋巴细胞白血病(ALL)、淋巴瘤和浆细胞骨髓瘤(PCM)等方面。然而,CAR-T细胞疗法在实体瘤治疗中的效果仍不尽如人意。这促使研究人员开始探索替代性的免疫治疗方法,以克服当前CAR-T细胞面临的重大挑战。具有强大吞噬能力、抗原呈递功能以及能够调节肿瘤微环境和刺激适应性反应的巨噬细胞成为一种有前景的选择。
CAR-M疗法(CAR-巨噬细胞疗法)利用巨噬细胞的特性,通过基因工程手段赋予其特定的抗肿瘤能力。巨噬细胞在肿瘤中的主要作用包括吞噬癌细胞、分泌细胞因子和趋化因子、渗透致密组织并在肿瘤中积累等。这些特性使得巨噬细胞成为CAR免疫疗法中可操作的候选者。自2006年Biglari等人首次将CEA靶向的CAR分子工程化到人类单核细胞中以来,CAR-巨噬细胞的开发和优化工作不断进行。目前已有两种CAR-M疗法(CT-0508和MCY-M11)获得美国食品药品监督管理局(FDA)的批准进入临床试验阶段。
尽管取得了一定进展,CAR-M疗法仍处于起步阶段,面临着细胞资源有限、基因转移抗性和潜在的炎症病理等重大问题。随着人类诱导多能干细胞(iPSCs)制备、基因编辑技术和生物材料递送技术的结合,新一代CAR-M疗法有望具备特定的肿瘤抗原识别能力、可行的基因修饰、改进的扩展能力和可控的安全性。6月1日Molecular Cancer “A new era of cancer immunotherapy: combining revolutionary technologies for enhanced CAR-M therapy”回顾了CAR-M疗法的最新进展,涵盖了基础科学研究和临床试验,并探讨了当前阻碍CAR-M疗法全面潜力实现的主要障碍及其解决策略。
随着基因编辑、合成生物学技术和生物材料支持的基因转移等革命性技术的出现,结合这些先进方法将带来新一代CAR-M疗法,提高其疗效、安全性和可及性。CAR-M疗法不仅展示了对抗血液和非血液肿瘤的潜力,还预示着未来在癌症免疫治疗中的广阔应用前景。

近年来,嵌合抗原受体(Chimeric Antigen Receptor, CAR)技术在癌症治疗领域取得了突破性进展,尤其是在血液肿瘤的治疗中。然而,CAR-T细胞(CAR-T Cell)在治疗实体肿瘤方面的效果仍然有限,这促使研究人员探索新的免疫治疗方法。巨噬细胞(Macrophages)作为先天免疫系统的主要细胞,因其多功能性和在肿瘤微环境中的重要作用,成为了CAR疗法的新兴候选者。
巨噬细胞是体内主要的吞噬细胞,能够吞噬并消化细菌、病毒和癌细胞等病原体。巨噬细胞不仅具有强大的吞噬能力,还具有抗原呈递(Antigen Presentation)功能,可以激活适应性免疫反应。此外,巨噬细胞在组织修复、炎症反应和免疫调节中发挥着重要作用。基于这些特性,研究人员开始探索将CAR技术应用于巨噬细胞,以开发新的癌症免疫治疗方法。
CAR-M疗法的研究进展
CAR-M的基本原理
CAR是一种人工设计的跨膜受体,通常包括一个识别肿瘤抗原的单链可变区(Single-chain Variable Fragment, scFv)、一个铰链区(Hinge Domain)、一个跨膜区(Transmembrane Domain)和一个胞内信号传导区(Intracellular Signaling Domain)。通过基因工程手段将CAR导入巨噬细胞,使其能够特异性识别并杀伤表达相应抗原的癌细胞。
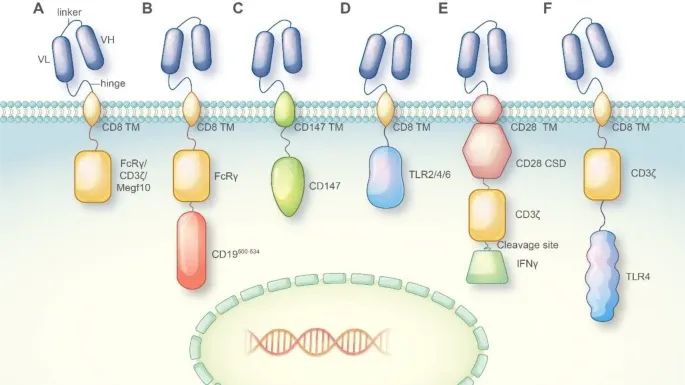
不同CAR的组成元素及其在CAR-巨噬细胞设计中的应用(Credit: Molecular Cancer)
CAR通常由以下部分组成:
单链可变区(Single-chain Variable Fragment, scFv):scFv是位于CAR细胞表面的部分,通过连接序列与肿瘤抗原靶向抗体的重链可变区(VH)和轻链可变区(VL)连接。
铰链区(Hinge Region): 铰链区通常源自CD8或CD28序列,提供了CAR分子的柔韧性,使其能够在识别抗原时进行适当的构象变化。
跨膜区(Transmembrane Region): 跨膜区负责将CAR分子嵌入细胞膜,通常也来源于CD8或CD28序列。
胞内激活区(Intracellular Activation Domain): 大多数CAR分子的胞内激活区由CD3ζ和41-BB或CD28区域组成,负责将抗原识别信号转导到细胞内部,激活细胞的免疫反应。
CAR-巨噬细胞设计中的不同胞内激活区:
在CAR-M的设计中,研究人员探索了多种胞内激活区,以赋予CAR-M不同的抗肿瘤能力:
吞噬域(Phagocytosis Domains): 将FcRγ、CD3ζ或Megf10等吞噬域整合到CAR中,使巨噬细胞能够吞噬抗原特异性的靶细胞并抑制肿瘤进展。
PI3K招募域(PI3K Recruiting Domain):FcRγ和PI3K招募域的串联能够实现对整个细胞的吞噬。
跨膜区和胞内域(Transmembrane and Intracellular Domain):CD147的跨膜区和胞内域用于CAR-M设计,能够分泌基质金属蛋白酶,帮助免疫细胞渗透肿瘤组织。
炎症信号传导域(Inflammatory Signaling Domains): 将TLR4或TLR2的胞内信号传导域整合到CAR框架中,能够诱导巨噬细胞向M1型极化,展现出抗肿瘤效应。
共刺激域和炎症细胞因子(Costimulatory Domain and Inflammatory Cytokine): 含有CD28共刺激域、CD3ζ吞噬域以及通过切割位点释放的M1型细胞因子IFN-γ的串联CAR分子,能够通过吞噬和促炎性抗肿瘤效应抑制肿瘤进展。
CD3ζ和TLR4胞内域的共表达(Co-expression of CD3ζ and TLR4 Intracellular Domain): 增强了巨噬细胞吞噬靶细胞的能力,并促进M1型极化。
CAR-M的早期研究
早在2006年,Biglari等人就成功将CEA(癌胚抗原)靶向的CAR分子导入人类单核细胞,并证明了这种疗法的可行性和安全性。自此之后,研究人员一直致力于开发和优化CAR-巨噬细胞疗法。初步研究表明,CAR-M治疗在血液肿瘤和非血液肿瘤的管理中具有潜力。
目前,已有两种CAR-M疗法(CT-0508和MCY-M11)获得美国食品药品监督管理局(FDA)的批准进入临床试验阶段。这标志着CAR-M疗法在实际临床应用中的重要一步。
CAR-M在实体瘤治疗中的挑战
尽管CAR-M疗法在血液肿瘤治疗中展示了潜力,但其在实体瘤中的应用仍面临诸多挑战。首先,实体瘤的致密组织结构和复杂的肿瘤微环境限制了CAR-M细胞的浸润和杀伤效应。其次,巨噬细胞在肿瘤微环境中容易被“教育”成支持肿瘤生长的M2型巨噬细胞,削弱其抗肿瘤功能。为了克服这些问题,研究人员正在探索多种策略,如优化CAR结构、结合其他免疫疗法以及利用生物材料辅助CAR分子的递送等。
CAR-M疗法的优势和潜力
巨噬细胞的多功能性
巨噬细胞在免疫系统中扮演着多重角色,包括吞噬病原体和癌细胞、分泌细胞因子和趋化因子以及调节免疫反应等。这些特性使巨噬细胞成为CAR免疫疗法的理想候选者。研究表明,CAR-M细胞不仅具有直接吞噬癌细胞的能力,还能够通过抗原呈递功能激活T细胞等适应性免疫反应,进一步增强抗肿瘤效果。
CAR-M疗法的优化策略
为了提高CAR-M疗法的效果,研究人员正在不断优化CAR的设计和巨噬细胞的工程改造。例如,通过引入不同的胞内信号传导区,如CD3ζ、FcRγ等,可以增强巨噬细胞的吞噬能力和抗肿瘤活性。此外,结合原位基因编辑(In Situ Gene Editing)、合成生物学(Synthetic Biology)和生物材料辅助基因递送等先进技术,可以进一步提升CAR-M疗法的安全性和有效性。
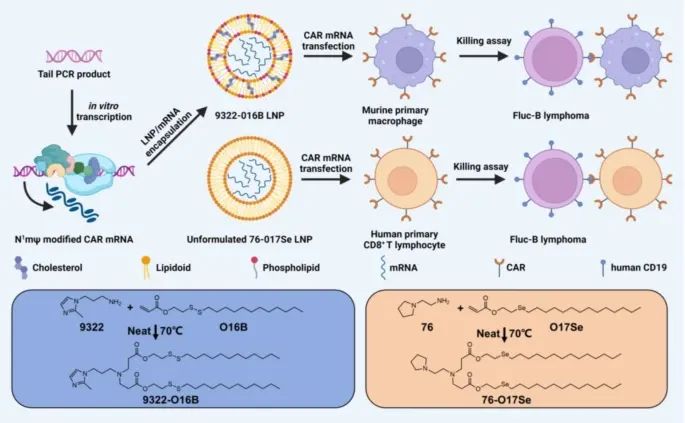
使用脂质纳米颗粒(Lipid Nanoparticles, LNPs)在体外系统中将编码CAR的mRNA递送至巨噬细胞和T细胞(Credit: Molecular Cancer)
这个系统主要是为了提高基因编辑的效率,使得这些免疫细胞能够高效表达CAR分子,从而增强其抗肿瘤活性。LNPs是一种先进的基因递送工具,其使用在mRNA疫苗(如新冠病毒疫苗)的成功应用引起了广泛关注。LNPs的优点包括高递送效率、低毒性和良好的生物相容性。研究人员利用LNPs将编码CAR分子的mRNA递送至巨噬细胞和T细胞,从而使这些细胞能够特异性识别并杀伤肿瘤细胞。
研究中,研究人员首先优化了LNPs的组成和mRNA的修饰,以提高其在巨噬细胞和T细胞中的转染效率。具体来说,他们筛选了一组脂质和mRNA,发现将磷脂酰乙醇胺(DOPE)掺入LNPs中对于核酸的递送至关重要。通过体外实验,研究人员证明这种优化的LNP-mRNA系统能够有效地将CAR mRNA递送至小鼠巨噬细胞和人类CD8+ T细胞,使这些细胞在表达CAR分子后表现出显著的细胞毒性作用,能够有效杀伤B细胞淋巴瘤细胞。
结合其他免疫疗法
除了优化CAR-M细胞本身,研究人员还探索将CAR-M疗法与其他免疫疗法结合使用,以实现协同抗肿瘤效果。例如,将CAR-M细胞与CAR-T细胞联合使用,可以利用巨噬细胞的肿瘤浸润能力和T细胞的强大杀伤能力,形成互补优势。此外,结合检查点抑制剂(Checkpoint Inhibitors)如抗PD-1抗体Pembrolizumab(帕博利珠单抗),可以进一步解除肿瘤微环境的免疫抑制,提高治疗效果。
CAR-M疗法的临床应用前景
随着CAR-M疗法的不断发展,越来越多的临床试验正在进行中,以评估其在不同类型癌症中的效果和安全性。CT-0508和MCY-M11是目前进展最快的两种CAR-M疗法,它们已获得FDA的批准进入临床试验,用于治疗HER2过表达的复发性或转移性实体瘤以及复发性/难治性卵巢癌和腹膜间皮瘤。
初步临床数据表明,CT-0508在患者中表现出良好的安全性和耐受性,没有明显的剂量相关毒性。此外,CAR-M疗法在局部递送时显示出更好的肿瘤抑制效果,这为未来的实体瘤治疗提供了新思路。
尽管CAR-M疗法在癌症治疗中展示了巨大的潜力,但其在临床应用中仍面临许多挑战。未来的研究需要继续优化CAR-M细胞的设计,提高其抗肿瘤效能,减少潜在的副作用。此外,探索更多高效的基因递送系统和联合治疗策略,将有助于推动CAR-M疗法在临床上的广泛应用。
随着基因编辑技术、合成生物学和生物材料科学的不断进步,我们有理由相信,CAR-M疗法将在不久的将来为癌症患者带来新的希望和更好的治疗选择。通过不断的研究和临床验证,CAR-M疗法有望成为癌症免疫治疗的重要组成部分,为攻克实体瘤这一难题提供有力的武器。
巨噬细胞CAR疗法作为一种新兴的癌症免疫治疗方法,展示了巨大的应用潜力。尽管面临诸多挑战,但通过研究人员的不懈努力和技术的不断进步,我们有理由相信,CAR-M疗法将在未来的癌症治疗中发挥越来越重要的作用,为更多的患者带来生的希望。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


