Cancer Res:武汉大学的研究者们揭示了一种增强子在癌症疾病中的作用机制
来源:生物谷原创 2024-03-22 15:00
该研究揭示了BRD4调控转录的KDM5C介导机制,为将BETi纳入与KDM5C抑制剂联合治疗以提高治疗效果提供了理论依据。
基因表达程序决定细胞命运,转录失调可导致多种疾病。最近,增强子破坏越来越多地被认为是一种疾病驱动机制,包括人类癌症。转录因子(TFs)、辅助因子和染色质调节因子参与维持增强子的活性状态;然而,调控协调的分子机制在很大程度上仍然不清楚。

图片来源: https://pubmed.ncbi.nlm.nih.gov/38285760/
近日,来自武汉大学的研究者们在Cancer Res杂志上发表了题为“KDM5C-mediated recruitment of BRD4 to chromatin regulates enhancer activation and BET inhibitor sensitivity”的文章,该研究揭示了BRD4调控转录的KDM5C介导机制,为将BETi纳入与KDM5C抑制剂联合治疗以提高治疗效果提供了理论依据。
BET家族成员BRD4是一种含溴结构域的蛋白,在驱动癌基因表达中起重要作用。鉴于BET抑制剂在各种癌症类型的致癌网络调节中的关键作用,其临床应用一直受到剂量限制性毒性和耐药性的阻碍。了解BRD4活性的机制和识别预测性生物标志物可以促进BETis的成功临床应用。
在这里,研究者发现KDM5C和BRD4协同维持肿瘤细胞的生长。在机制上,KDM5C与BRD4相互作用并刺激BRD4增强子的募集。此外,BRD4 c -末端与KDM5C的结合刺激了KDM5C的H3K4去甲基化酶活性。kdm5c相关BRD4和h3k4me /3的丰度决定了许多癌基因的转录激活。
值得注意的是,在肿瘤细胞系和患者来源的类器官模型中,KDM5C的耗损或药理降解显著降低了BRD4染色质的富集,并显著提高了BETi在多种癌症类型中的疗效。此外,在异种移植小鼠模型中,靶向KDM5C与BETi联合抑制肿瘤生长。
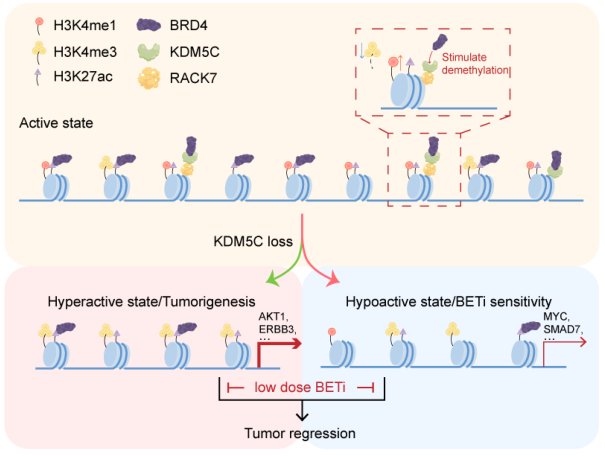
kdm5c介导的BRD4募集和组蛋白去甲基化模型维持增强子的活性状态
图片来源: https://pubmed.ncbi.nlm.nih.gov/38285760/
总之,本研究证明了KDM5C招募BRD4为活性增强子元件,并表现出更高的组蛋白去甲基化酶活性,以维持活性增强子状态并调节基因表达模式。这些发现为开发新的癌症联合疗法提供了线索。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


