PNAS | 武汉大学张金方团队发现USP8调控的GPX4稳态能够协调铁死亡和癌症免疫治疗
来源:生物探索 2024-05-06 09:16
该研究报道了在肠上皮细胞( IECs )中Usp8的纯合缺失缩短了小鼠的生存期,并伴随着结肠结构紊乱和结肠组织中脂质过氧化的增加。
武汉大学张金方团队在PNAS上在线发表题为“USP8-governed GPX4 homeostasis orchestrates ferroptosis and cancer immunotherapy”的研究论文。该研究报道了在肠上皮细胞( IECs )中Usp8 (泛素特异性蛋白酶8 )的纯合缺失导致结肠上皮的结构变化,并缩短了小鼠的寿命,同时伴随着IEC死亡和脂质过氧化迹象的增加。然而,IECs中Usp8杂合缺失的小鼠表现出正常的表型,并对氧化偶氮甲烷/葡聚糖硫酸钠诱导的结直肠肿瘤发生产生抗性。
在机制上,USP8与谷胱甘肽过氧化物酶4 ( GPX4 )相互作用并使其去泛素化,导致GPX4的稳定。因此,在体外抑制USP8可以使GPX4去稳定化,增强癌细胞对铁死亡的敏感性。值得注意的是,USP8抑制联合ferroptosis诱导剂可延缓肿瘤生长并增强CD8 + T细胞浸润,从而增强体内抗PD - 1免疫治疗的肿瘤反应。这些发现揭示了USP8通过稳定GPX4来抵抗铁死亡,并强调了靶向USP8作为一种潜在的治疗策略来促进铁死亡,以增强癌症免疫治疗。

铁死亡是一种非凋亡形式的调节性细胞死亡,是脂质过氧化物以铁依赖性方式积累的结果,在调节各种生理和病理过程中发挥关键作用。胱氨酸-谷氨酸反向转运体( System xc - ) /谷胱甘肽( GSH ) /谷胱甘肽过氧化物酶4 ( GPX4 )轴是通过将潜在毒性的磷脂氢过氧化物转化为无毒的脂醇,从而抑制铁死亡和促进肿瘤发生的监视机制之一。越来越多的证据表明,通过靶向系统xc - / GPX4途径促进铁死亡是一种潜在的癌症治疗策略。
值得注意的是,一些靶向系统xc -或GPX4的选择性小分子抑制剂已经被开发出来,并在体外和体内中通过触发肿瘤细胞铁死亡而显示出强大的抗肿瘤作用。此外,越来越多的证据表明,这些铁死亡诱导剂可以在多个临床前肿瘤模型中进一步加强目前癌症治疗,包括放射治疗、化疗和免疫治疗的抗肿瘤疗效。然而,控制铁死亡敏感性的分子调控机制,以及这些调控如何影响肿瘤发生和癌症治疗仍然在很大程度上是不清楚的。因此,阐明调控铁死亡的分子机制对于开发先前未被重视的提高抗癌疗效的联合疗法具有重要价值。
由泛素E3连接酶和去泛素化酶( DUBs )控制的蛋白质泛素化和去泛素化在调节蛋白质稳态以控制各种生物过程中发挥重要作用。泛素系统的失调与人类疾病有关,包括癌症。一些DUBs正在成为癌症治疗的有吸引力的治疗靶点,越来越多针对各种DUBs的选择性小分子抑制剂已被开发用于临床前动物肿瘤模型中的癌症治疗。泛素特异性蛋白酶8 ( USP8 ,又名UBPY)是去泛素化酶家族中的一员,经常从底物上移除泛素化修饰以控制细胞蛋白命运。最近的研究表明,USP8在调节细胞分裂和肿瘤发生中发挥重要作用。此外,研究发现USP8通过不同的机制赋予肝癌细胞铁死亡抗性。然而,USP8是否在组织稳态和癌症免疫治疗中调节铁死亡尚不完全清楚。
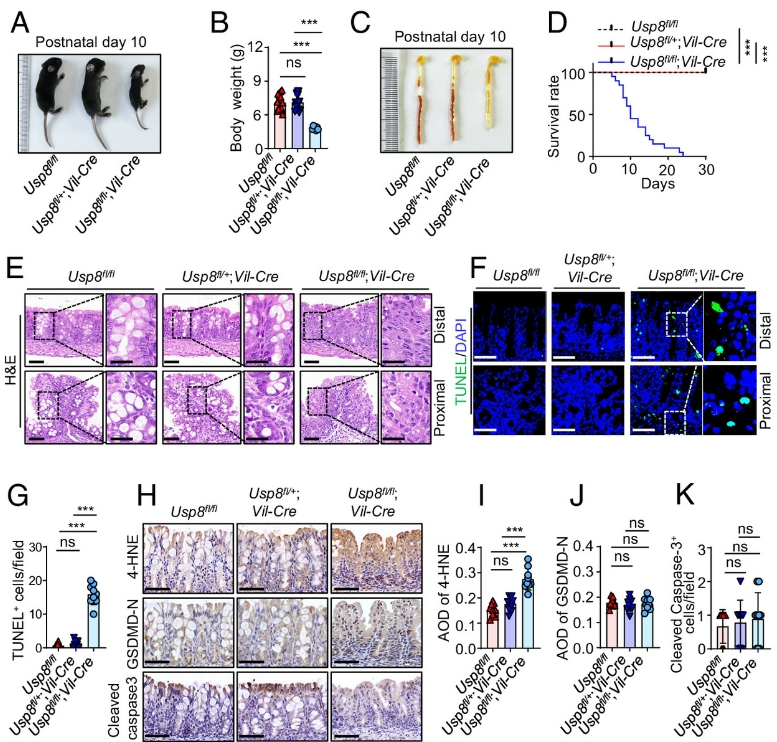
IECs中Usp8的纯合子缺失会缩短小鼠寿命,并伴有结肠稳态受损和IECs死亡增加(Credit: PNAS)
基于此,该研究报道了在肠上皮细胞( IECs )中Usp8的纯合缺失缩短了小鼠的生存期,并伴随着结肠结构紊乱和结肠组织中脂质过氧化的增加。然而,在IECs中杂合缺失Usp8的小鼠是存活的,并且表现出与野生型( WT )小鼠相当的表型。在小鼠结直肠癌模型中,Usp8的杂合缺失阻碍了结肠癌的发生和肿瘤进展。
敲低或药理学抑制USP8增加了结直肠癌细胞对铁死亡的敏感性。USP8与GPX4相互作用并使其去泛素化,从而阻止GPX4蛋白降解。值得注意的是,USP8抑制联合ferroptosis诱导剂抑制了肿瘤的生长,并促进了肿瘤微环境中CD8 + T细胞的浸润,使体内PD - 1 / PD - L1阻断更加有效。总之,该研究阐明了USP8通过稳定GPX4抑制广泛的脂质过氧化和铁死亡的生理作用,并强调了靶向USP8 - GPX4轴作为增强抗PD - 1免疫治疗疗效的潜在策略。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


