清华大学张从刚团队揭示微管去稳定剂联合STING激动剂的抗肿瘤免疫治疗策略及其机制
来源:生物世界 2023-04-10 11:02
该研究深入解析了微管去稳定剂增强cGAMP-STING通路的分子机理。明确表明Podofilox通过抑制微管聚合,破坏STING激活后囊泡的正常转运并显著延缓了STING降解
cGAS-STING通路是天然免疫信号通路识别细胞质异常DNA的主要传感机制[1]。在哺乳细胞中cGAS与DNA结合后被激活,催化合成独特的第二信使分子cGAMP。cGAMP与干扰素基因刺激因子(STING)结合后,招募并激活TBK1和IRF3,进而诱导I型干扰素(IFNs)和其他细胞因子的产生。IFNs的产生能诱导数百种IFNs—刺激基因(ISGs)的表达,这对培养持续的肿瘤特异性T细胞极其重要。因此,STING成为癌症免疫治疗的潜在靶点。
尽管有效的STING激动剂被开发(包括环二核苷酸类,非核苷酸类化学小分子,ADC偶联的STING激动剂等),但STING激动剂,以及激动剂与PD-1/PD-L1联用的临床抗肿瘤试验结果并不理想;最近报道的ADC偶联的STING激动剂药物XMT-2056在一期临床试验中出现了致命的副作用。因此,STING激动剂的开发任重道远,需要继续探索新的治疗策略,以期望控制过度的免疫激活、降低免疫抑制和毒副作用,从而用于癌症免疫治疗。
近日,清华大学药学院张从刚课题组与合作者在美国癌症研究协会(AACR)旗下学术期刊 Cancer Immunology Research 上发表了题为:Discovery of Podofilox as a Potent cGAMP–STING Signaling Enhancer with Antitumor Activity 的研究论文。
该研究通过高通量筛选,发现一系列微管去稳定剂(如:Podofilox、Nocodazole、Colchicine、 Vincristine sulfate等),均能显著增强多种STING激动剂介导的天然免疫反应,进而发挥强大的抗肿瘤作用。
研究团队以FDA批准临床抗病毒外用药Podofilox为代表性分子深入解析了微管去稳定剂调控cGAMP-STING通路的分子机理,发现Podofilox通过抑制微管聚合、分散高尔基体、改变了STING激活后从ER到高尔基体的转运路线。其次,Podofilox延缓STING降解,持续可控地放大STING依赖的I型干扰素信号进而促进肿瘤特异性T细胞浸润,并改善了肿瘤微环境。

研究团队将微管去稳定剂与STING激动剂联合用于肿瘤免疫治疗领域,并以Podofilox和cGAMP作为概念性证据,揭示了微管去稳定剂+STING激动剂在多种肿瘤模型(包括人肺癌类器官模型)中具有惊人的抗肿瘤治疗效果。该研究提示可以通过STING激动剂和微管去稳定剂的精准联用,从而启动持续的STING天然免疫激活。考虑到众多微管去稳定剂正在用于临床癌症治疗,该发现具有广泛的开发潜力和应用前景,有望为癌症免疫治疗提供全新的联合治疗方案。
研究团队首先以cGAS-STING天然免疫通路激活为表型,对市售小分子库进行高通量筛选(~150000 compounds),发现了一个非常有趣的现象,多种结构不同的微管去稳定剂(或称微管解聚剂),包括常用的长春花生物碱家族、秋水仙碱和MMAE等,能显著增强cGAMP-STING信号通路。
随后,研究团队对比微管稳定剂(Paclitaxel、Docetaxel)和DNA拓扑异构酶(Etoposide、Topotecan)对该通路的影响,发现仅有微管去稳定剂能显著增强cGAMP-STING信号转导(图1)。其中, Podofilox对cGAMP-STING信号通路的增强作用最为显著,且具有严格的浓度依赖性(有效协同浓度低至nM浓度水平)。

图1. 仅有微管去稳定剂能增强cGAMP-STING信号
接下来,研究团队探究Podofilox对不同STING激动剂(CDNs、DMXAA、STING-agonist-3)介导天然免疫反应的作用。此外,为了判定Podofilox对cGAMP-STING通路作用的特异性,研究者通过基因敲除(STING KO),小分子或仙台病毒(SeV)等(LPS诱导TLR通路激活;Poly(I:C)和SeV诱导RNA通路激活)诱导不同天然免疫通路的激活,进一步确定Podofilox能特异性增强STING信号级联,并显著促进I型干扰素产生和ISGs基因表达(图2)。
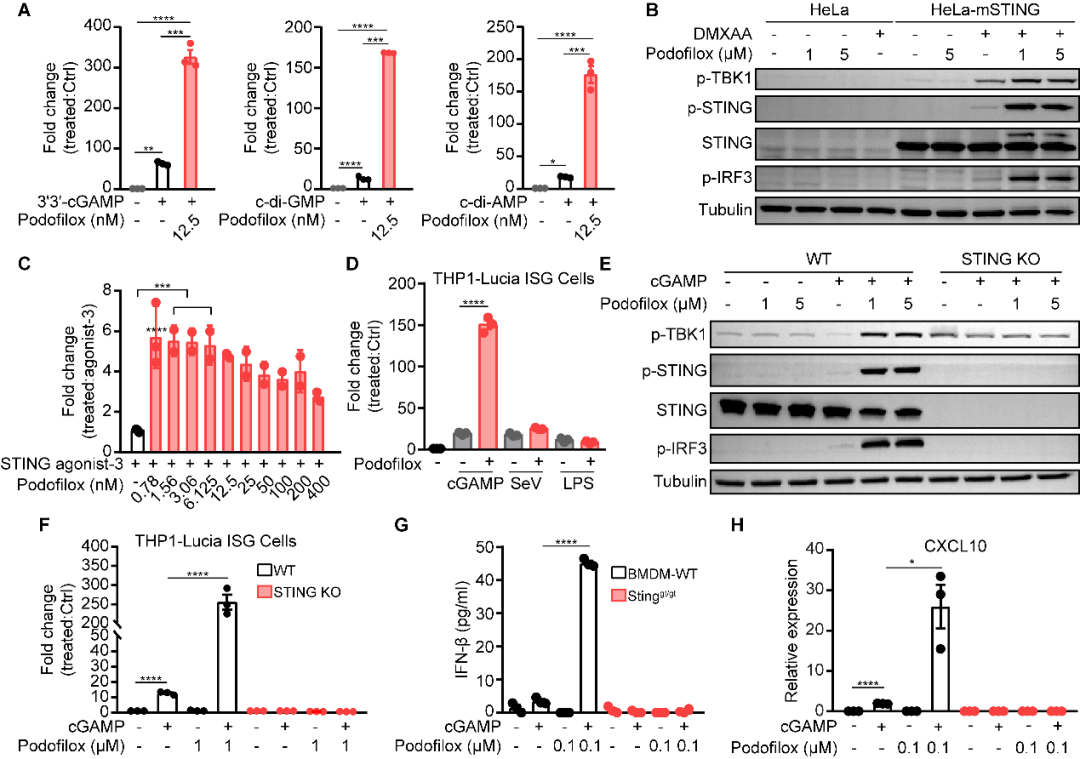
图2. Podofilox特异性增强STING依赖的IFNs信号通路
由于间接IFN-α/β受体(IFNAR)信号通路也能介导ISGs基因的表达。研究者通过使用anti-IFNAR2抗体拮抗间接信号通路、基因敲除(Stat1 KO、Stat3 KO),以及IFNAR2激动剂(RO8191)刺激等方式,进一步确定Podofilox通过经典的STING-TBK1-IRF3信号轴促进了ISGs基因的表达(图3)。
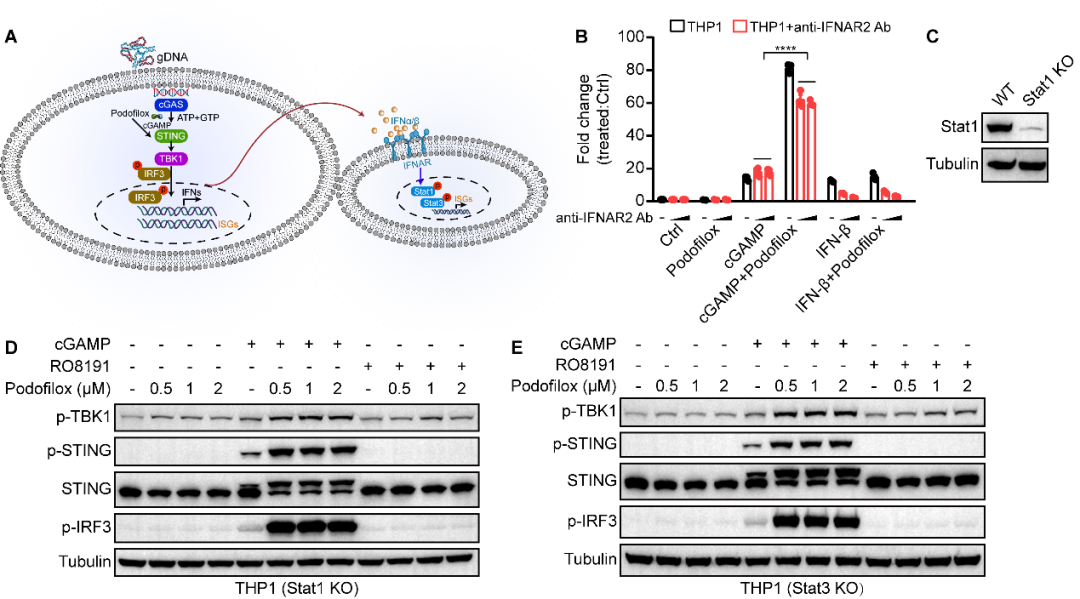
图3. Podofilox主要通过直接的STING信号通路增强cGAMP介导的免疫反应
接下来,研究团队系统性解析了Podofilox增强STING信号的分子机理。研究者首先通过构建稳定表达STING-GFP的细胞系可视化了STING激活后的转运过程,发现Podofilox分散了cGAMP介导的STING核周puncta为贯穿整个细胞质的微小囊泡,在这些囊泡中诱导更强的STING寡聚化及TBK1、IRF3的磷酸化(图4)。
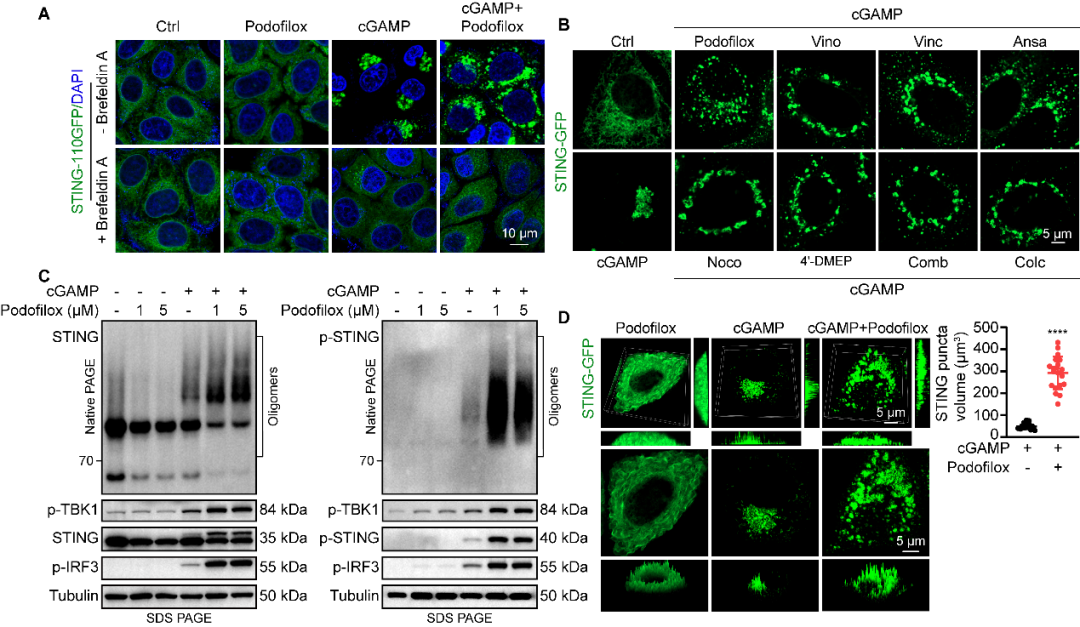
图4. Podofilox增加STING puncta数量,持续增强cGAMP-STING信号通路
研究团队推测,这些微管解聚剂诱导的STING散点表型可能通过破坏微管网络,扰乱了STING激活后囊泡在细胞内的正常运输。不出所料,我们通过超高分辨成像、免疫染色,及活细胞的延时拍摄发现cGAMP刺激后STING在60 min内从ER转运至高尔基体,并最终到达溶酶体被降解终止信号。然而,Podofilox通过抑制微管聚合,分散高尔基体改变了cGAMP刺激后STING转运模式,并显著延缓转运中启动的STING降解和信号关闭(图5)。
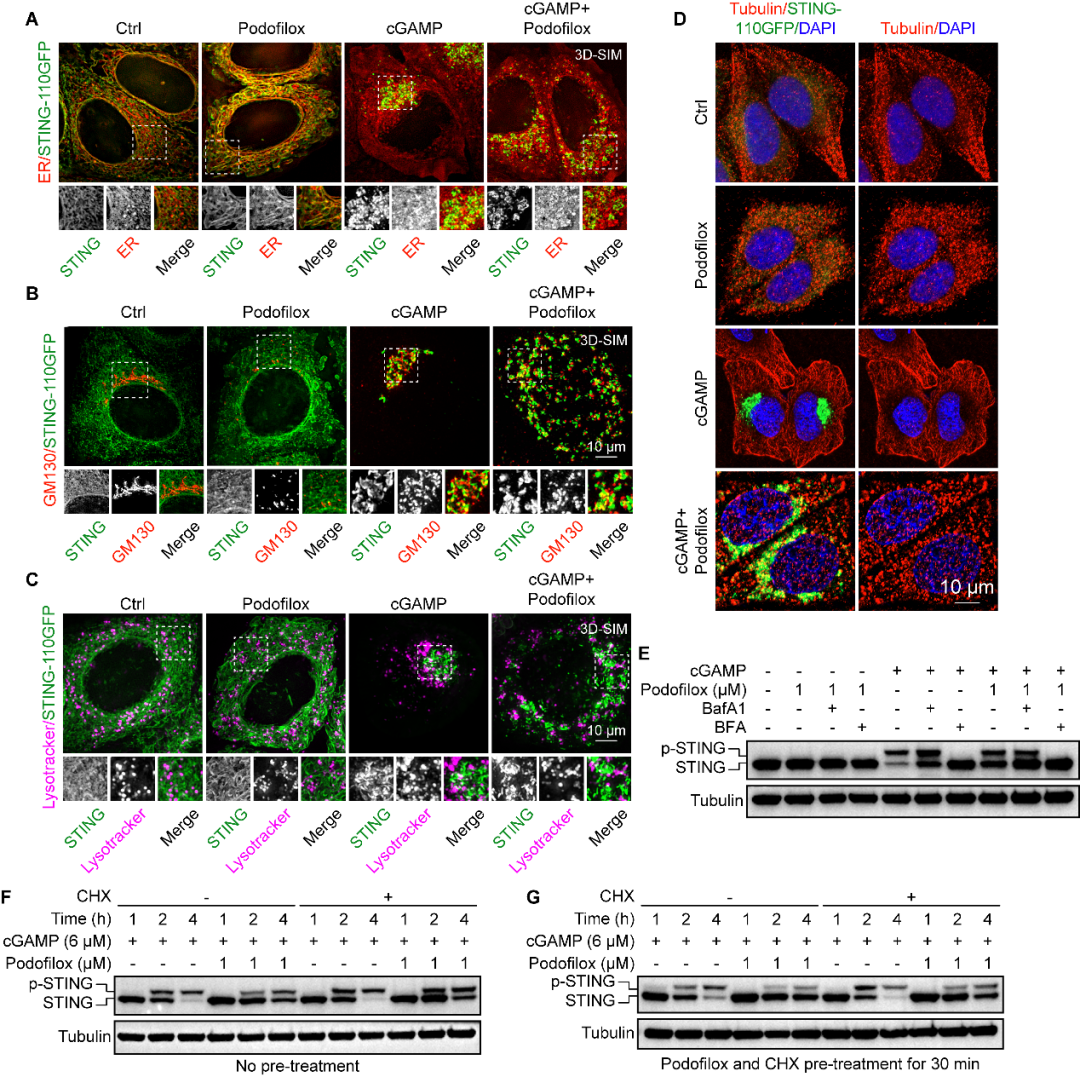
图5. Podofilox通过抑制微管聚合,分散高尔基体,改变了STING激活后的转运路线并显著延缓了STING降解
此外,Podofilox增强cGAMP介导的免疫反应是否能应用于肿瘤的免疫治疗呢?研究者分别在人肺癌类器官,小鼠肿瘤模型(B16F10黑素瘤;4T1乳腺癌)中进一步探究微管去稳定剂和STING激动剂联合的抗肿瘤疗效。该团队的研究结果表明,Podofilox以宿主STING依赖的方式促进cGAMP抗肿瘤活性和淋巴细胞免疫浸润,并改善了肿瘤免疫微环境进而发挥了强大的抗肿瘤作用,尤其是二者与PD-L1抗体联合能进一步扩大治疗效果。此外,在肿瘤类器官上的抗肿瘤作用强于肺癌一线化疗药Gemcitabine + Cisplatin。这些数据表明,微管去稳定剂与STING激动剂联合可能在治疗癌症方面拥有巨大的潜力(图6)。
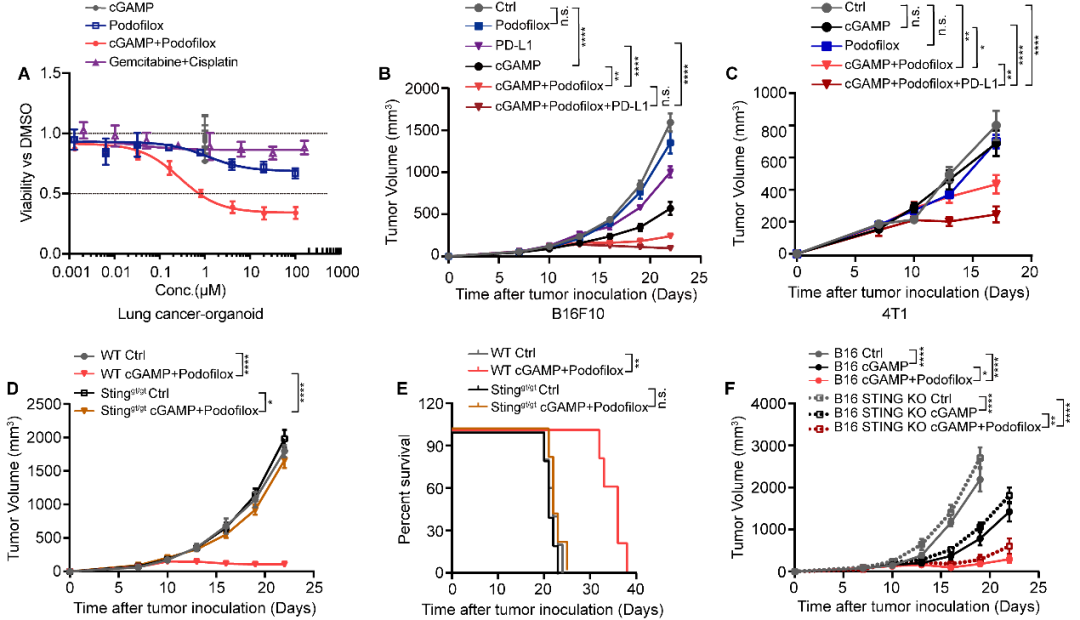
图6. Podofilox以宿主STING依赖的方式在体内增强了cGAMP的抗肿瘤作用
综上所述,该研究深入解析了微管去稳定剂增强cGAMP-STING通路的分子机理。明确表明Podofilox通过抑制微管聚合,破坏STING激活后囊泡的正常转运并显著延缓了STING降解,进而诱导了更多的I型干扰素(IFNs)产生和更强的抗肿瘤免疫。在肿瘤模型中,Podofilox通过IFNs依赖的T细胞激活抑制肿瘤生长,并促进肿瘤内T细胞浸润和PD-L1表达,这项研究扩大了肿瘤免疫治疗的益处,并可能为临床癌症的治疗提供指导意义。
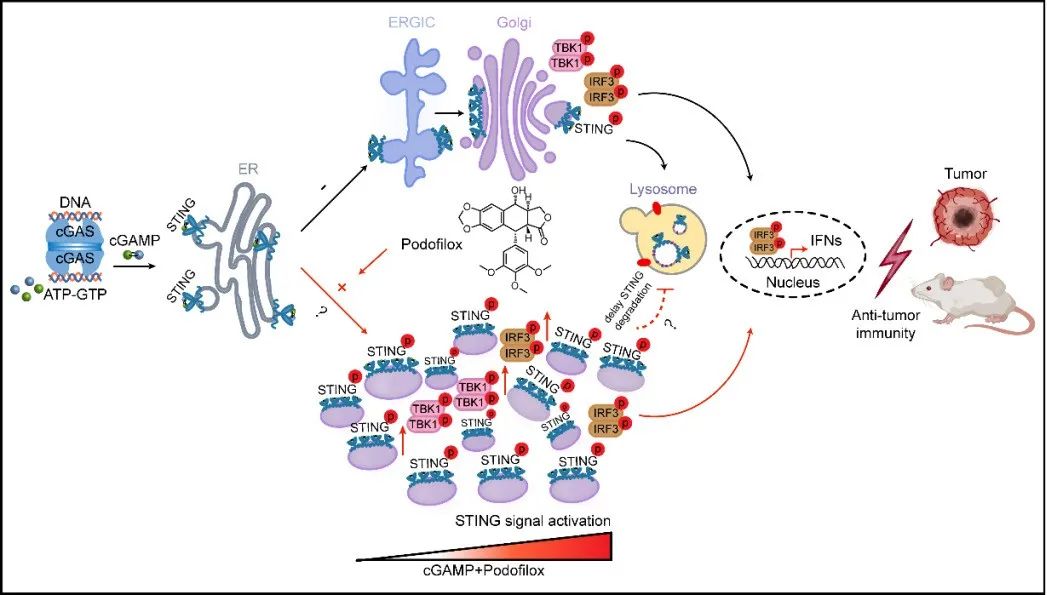
Podofilox破坏微管网络分散cGAMP介导的STING puncta进而放大STING信号级联发挥抗肿瘤作用
清华大学药学院张从刚课题组博士后韩晶、UTSW的胡水清和清华大学医学院博士后胡亚伟为论文共同第一作者。清华大学药学院张从刚研究员、清华大学医学院刘鹏研究员和上海交通大学基础医学院孙序序研究员为论文通讯作者。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


