《科学·转化医学》:清除靶向治疗残余耐药癌细胞的方法找到了
来源: 奇点糕 2022-05-05 14:26
不同于“杀敌一千,自损八百”的化疗,癌基因靶向治疗因精准作用于致癌靶点而被称为“生物导弹”。
不同于“杀敌一千,自损八百”的化疗,癌基因靶向治疗因精准作用于致癌靶点而被称为“生物导弹”。
近年来,多种靶向治疗药物已成功应用于临床,然而,晚期肿瘤患者实际获益并不理想,其中一个重要原因就是:耐药。而我们对靶向治疗获得性耐药的发生机制知之甚少。
有研究发现,在靶向治疗中存活下来的残留癌细胞,及随后发生的DNA损伤修复是肿瘤细胞产生耐药性的重要原因[1]。因此,探寻靶向治疗诱导的DNA损伤修复相关分子,明确肿瘤耐药性的发生机制,对于靶向药物的研发和临床方案的选择有着至关重要的作用。
近日,美国杜克大学Kris C. Wood博士及其团队研究发现,靶向治疗后存活下来的肿瘤细胞中,存在DNA双链断裂(DSB)和DNA双链断裂修复,这一修复过程依赖于共济失调毛细血管扩张突变(ATM)酶。
他们还发现,靶向治疗药物与ATM抑制剂联合使用,可根除体外细胞株和动物模型中存活的残余肿瘤细胞,进而产生更持久的治疗反应[2]。
这一研究成果为临床研发ATM抑制剂与现有靶向治疗方案的整合奠定了理论基础,相关研究成果近期发表在著名期刊《科学·转化医学》(Science Translational Medicine)上。

论文首页
接下来,我们看看这项研究是如何开展的。
首先,为了研究靶向治疗是否会激活DNA损伤应答信号通路(DDR),研究团队使用了一组对同源靶向治疗敏感的肿瘤细胞株:表皮生长因子受体(EGFR)突变型非小细胞肺癌(NSCLC)细胞株(PC9、HCC827),间变性淋巴瘤激酶(ALK)基因重排型NSCLC细胞株(H3122),BRAF基因突变型黑色素瘤细胞株(A375),FLT3基因突变型急性髓系白血病(AML)细胞株(MOLM13),KRAS基因突变型胰腺癌细胞株(MIA PaCa-2)和NSCLC细胞株(A549)。
在用不同剂量的同源靶向治疗药物处理上述细胞株24小时后,他们发现S1981位点被磷酸化的ATM(p-ATM)和γH2AX表达明显增加。需要指出的是,ATM S1981位点磷酸化是激活下游DNA损伤应答信号通路所必需的位点,H2AX(组蛋白H2A家族成员X)磷酸化产生的γH2AX是DNA双链断裂的生物标志物。
接下来的细胞克隆形成实验表明,在不影响细胞活力的药物剂量下,仍然观察到γH2AX表达明显增加,这一结论在三种吉非替尼(Gefitinib)耐药EGFR突变型NSCLC细胞株(PC9R、GR4、WZR12)中得到了进一步验证;同时,在接受靶向药物处理的PC9和A549细胞中观察到膜联蛋白V染色(用于检测细胞凋亡)为阴性。
最后,中性彗星试验(在单细胞水平检测DNA损伤的技术)发现,PC9和A549细胞靶向药物处理24小时后检测到DNA双链断裂的存在,表明观察到的ATM激活是由于DNA损伤所致。
以上结果表明,在靶向治疗中存活的肿瘤细胞会出现DNA双链断裂和随后的ATM激活。
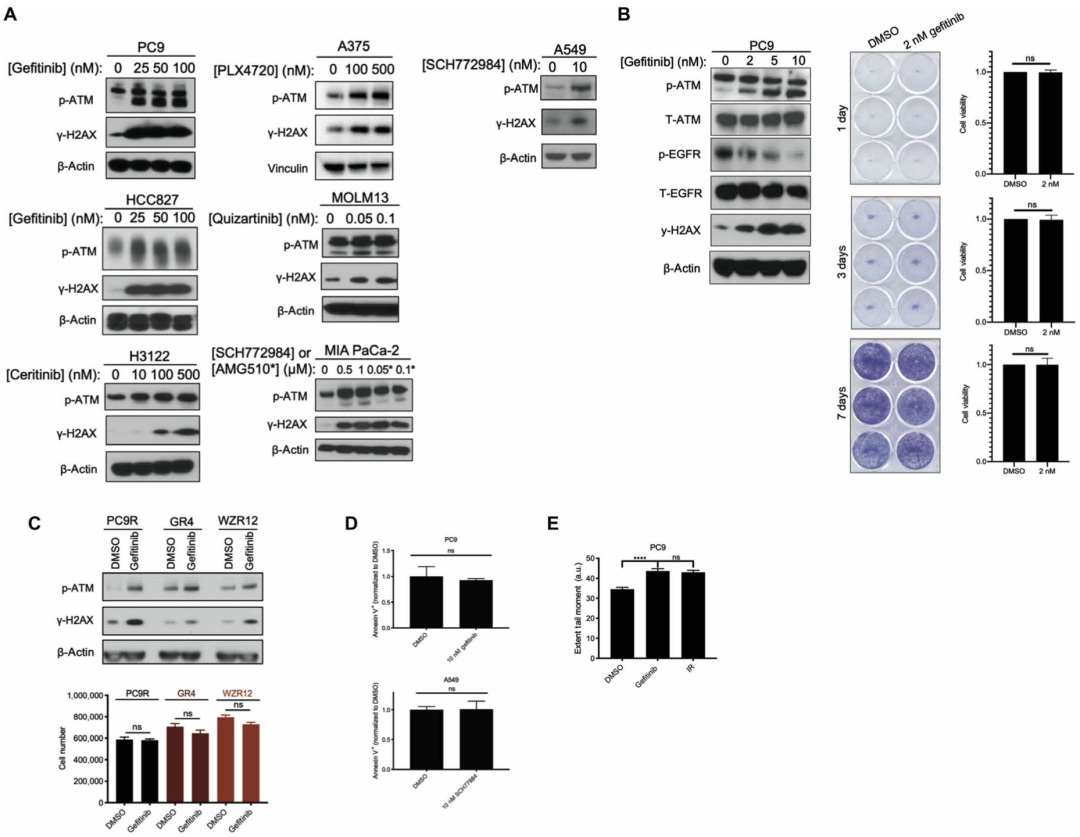
靶向药物处理的肿瘤细胞中DNA损伤应答信号通路被激活
那么,ATM又是如何被激活的呢?我们接着往下看。
首先,PC9和HCC827细胞用吉非替尼(EGFR阻断剂)处理24小时后,观察到ATM及其底物检查点激酶2(Chk2)T68位点磷酸化表达增加;随后,研究人员分别用ATM激酶抑制剂(AZD0156)单独或与吉非替尼联合使用处理PC9细胞,发现AZD0156和吉非替尼联合使用可消除γH2AX的表达和DNA双链断裂修复途径的激活。
在接下来的实验中,研究人员发现,随着吉非替尼使用剂量和处理时间的增加,p-ATM和γH2AX表达也逐渐增加,同时启动者半胱天冬酶9(initiator caspase 9)和执行者caspase 3均被切割。
最近的一项研究表明,内源性途径半胱天冬酶的激活可导致DNA双链断裂的形成和随后的ATM激活[3]。因此,研究人员假设Bcl-2抗凋亡家族成员BIM和BAK/BAX激活下游的半胱天冬酶,以及由此产生的线粒体外膜通透性(MOMP)增加,可能是DNA双链断裂以及ATM激活的原因。
为了验证这一假设,他们在PC9细胞中分别敲除BIM和敲降BAX的表达,发现BIM和BAX低表达可消除靶向治疗诱导的ATM和γH2AX的激活。为了进一步验证这一假设,研究人员单独使用泛半胱天冬酶抑制剂(Q-VD-OPh)或与吉非替尼联合使用处理PC9细胞,发现两者联合使用可消除仅使用吉非替尼处理时观察到的ATM激活。
在PC9细胞中同时敲除caspase 3和7,同样可以消除吉非替尼处理的PC9细胞中ATM和γH2AX的激活。半胱天冬蛋白酶激活的脱氧核糖核酸酶(CAD)是一种由caspase 3和7激活的介导DNA双链断裂的关键酶,在用吉非替尼处理的PC9细胞中脱氧核糖核酸酶表达如何呢?
结果显示,脱氧核糖核酸酶表达相对不变,但是胱天蛋白酶激活的脱氧核糖核酸酶抑制因子(ICAD)的表达显著降低;研究人员进一步在PC9细胞中敲除脱氧核糖核酸酶表达,发现吉非替尼处理的PC9细胞中未观察到γH2AX的激活,但仍然观察到caspase 3被切割以及脱氧核糖核酸酶抑制因子的丢失。
以上结果表明,脱氧核糖核酸酶抑制因子的低表达导致脱氧核糖核酸酶激活,并随之诱导了DNA双链断裂和ATM的激活并且caspase的激活和脱氧核糖核酸酶抑制因子的缺失在脱氧核糖核酸酶激活上游起作用。
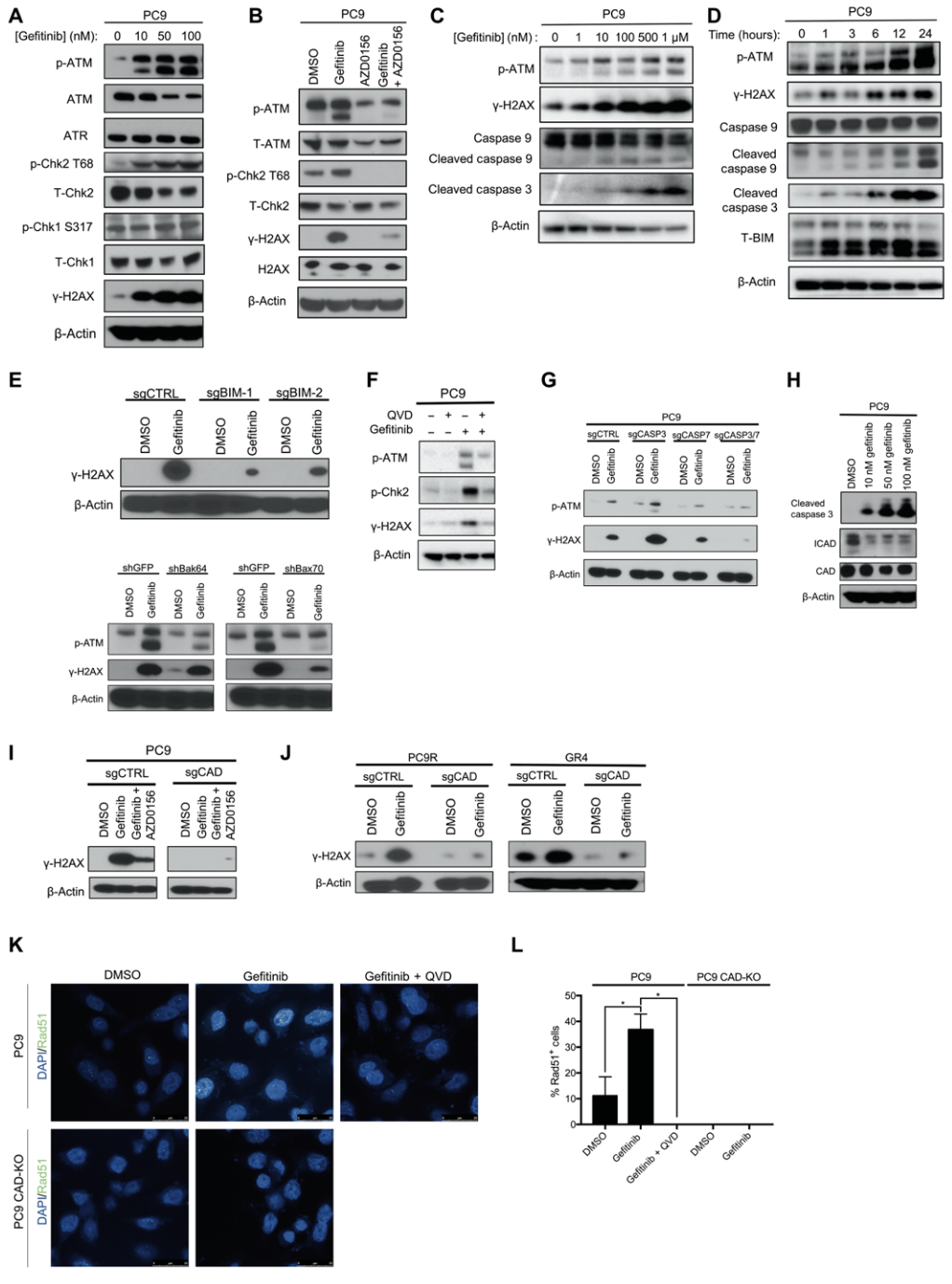
EGFR抑制剂诱导ATM信号通路激活
上述结果表明,在靶向治疗中存活的细胞可能需要ATM激活来修复靶向治疗暴露引起的DNA双链断裂。那么ATM抑制剂是否可以改善靶向治疗反应强度和持续时间呢?
首先,前面的实验已证实AZD0156可以阻断吉非替尼诱导的ATM激活,随后研究人员单独使用AZD0156或与吉非替尼联合处理PC9、PC9R、GR4细胞发现,AZD0156可以同时增加对靶向药物敏感细胞株(PC9)和对靶向药物耐药细胞株(PC9R、GR4)对吉非替尼的敏感性。
这说明EGFR抑制剂治疗后残留的肿瘤细胞,对EGFR抑制剂和ATM抑制剂联合使用仍然敏感,这种联合治疗方案可以清除在EGFR抑制剂单一治疗后存活的肿瘤细胞。接下来,研究团队对这一结论进行了进一步的验证。
在长期定性进展时间(TTP)分析中观察到AZD0156对细胞生长的影响很小,而吉非替尼单药治疗在大约40天左右导致肿瘤细胞耐药性增加,而吉非替尼和AZD0156联合治疗可有效清除残留肿瘤细胞,从而避免耐药肿瘤细胞的生长。
最后,研究团队评估了脱氧核糖核酸酶在EGFR抑制剂和ATM抑制剂联合使用中对细胞反应的影响。研究发现,在PC9和GR4细胞中敲除脱氧核糖核酸酶的表达后,可以逆转联合治疗对肿瘤细胞生长抑制作用。接下来,抑制ATM的表达后,发现ATM的缺失消除了吉非替尼诱导的γH2AX的激活,表明AZD0156通过靶向ATM抑制发挥作用。
总之,这些结果表明,在EGFR抑制剂治疗后存活的肿瘤细胞中,脱氧核糖核酸酶介导的DNA双链断裂形成对ATM具有合成依赖性,ATM是解决这种DNA损伤的关键激酶。因此,EGFR抑制剂和ATM抑制剂联合使用,可清除在EGFR抑制剂单一疗法下存活的肿瘤细胞,进而抑制耐药性肿瘤细胞的生长。
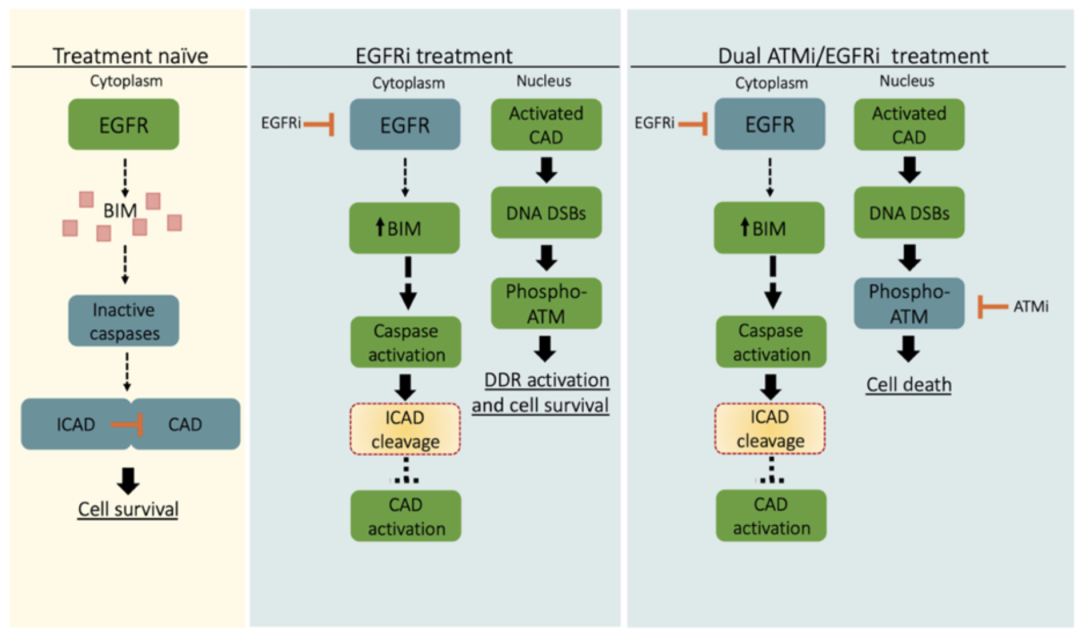
机制示意图
体外细胞实验已证实,EGFR抑制剂和ATM抑制剂联合使用可抑制耐药性肿瘤细胞的生长,那么,这一治疗组合是否会阻止体内肿瘤的生长呢?接下来,研究团队进行了体内异种移植实验,我们一起看看结果如何。
研究发现,单独使用ATM抑制剂对肿瘤生长几乎没有影响,EGFR抑制剂在肿瘤产生耐药性之前可抑制肿瘤的生长,ATM抑制剂和EGFR抑制剂联合治疗的小鼠在整个研究期间显示出持续的肿瘤消退。
随后,研究团队使用从肺癌患者肿瘤组织中提取的三种细胞模型,MGH134(来自EGFR突变NSCLC患者且对一线厄洛替尼治疗产生耐药)、MGH1109(来自EGFR突变NSCLC初治患者)、MGH006(来自EML4-ALK变体1突变NSCLC初治患者)进行了进一步验证。
结果显示,ATM抑制剂可以抑制在靶向治疗中耐药肿瘤的增长;与这一发现一致,在MGH134异种移植小鼠中,奥希替尼治疗产生了最初的生长抑制,随后肿瘤进展,而奥希替尼与AZD0156的联合治疗产生了持续的肿瘤消退。
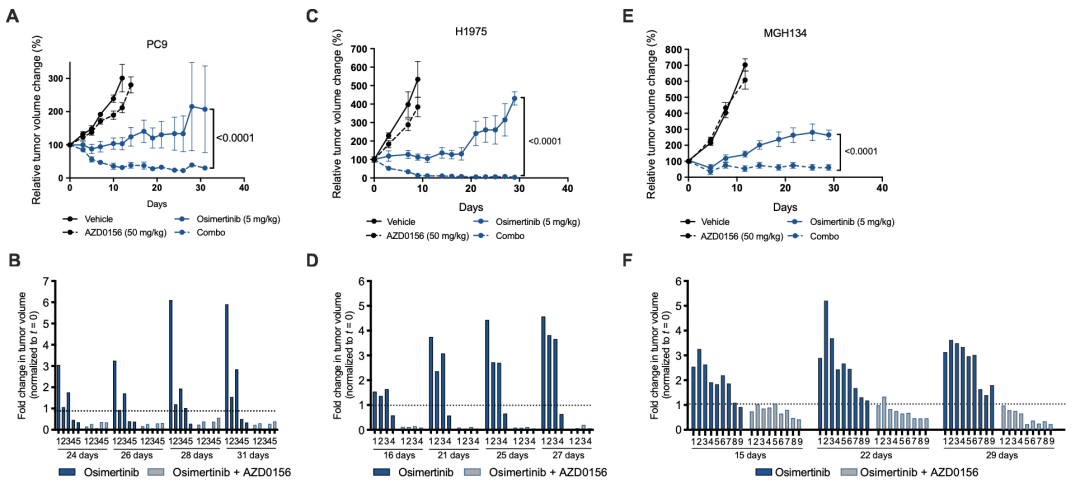
靶向治疗在小鼠异种移植模型中诱导ATM激活
研究最后,为了探索这些实验结果与临床可能存在的相关性,研究团队分析了接受EGFR抑制剂治疗的患者的肿瘤组织中ATM激活情况。
首先,研究人员对5名EGFR突变NSCLC患者肿瘤组织进行了免疫组织化学(IHC)染色,结果显示,与接受EGFR抑制剂厄洛替尼治疗前相比,治疗期间肿瘤组织中p-ATM表达明显增加;进一步对所有患者肿瘤样本进行综合分析发现,在接受厄洛替尼治疗的进展性患者肿瘤组织中p-ATM表达显著增加。
接下来,研究人员分析了Sloan-Kettering可操作癌症靶点(MSK-IMPACT)临床测序队列数据库中11名接受一线厄洛替尼治疗的患者临床进展时间数据,这11名患者同时发生了EGFR突变/厄洛替尼致敏突变和ATM突变。
分析结果显示,与没有ATM突变的EGFR突变NSCLC患者相比,伴有ATM功能缺失突变的EGFR突变NSCLC患者的无进展生存期延长。出现ATM功能丧失突变的肿瘤患者中,厄洛替尼治疗的疾病进展时间(TTP)为17.8 ± 10.9个月,而在那些可能存在非功能性ATM突变的肿瘤患者中,TTP为9.0± 1.9个月;这一结果,与未经选择的EGFR突变NSCLC患者接受一线厄洛替尼治疗的多个研究中观察到的8到12个月的临床进展时间一致[4]。
以上这些数据表明,ATM激活发生在EGFR抑制剂治疗后存活的肿瘤细胞中,可能起到肿瘤保护作用。
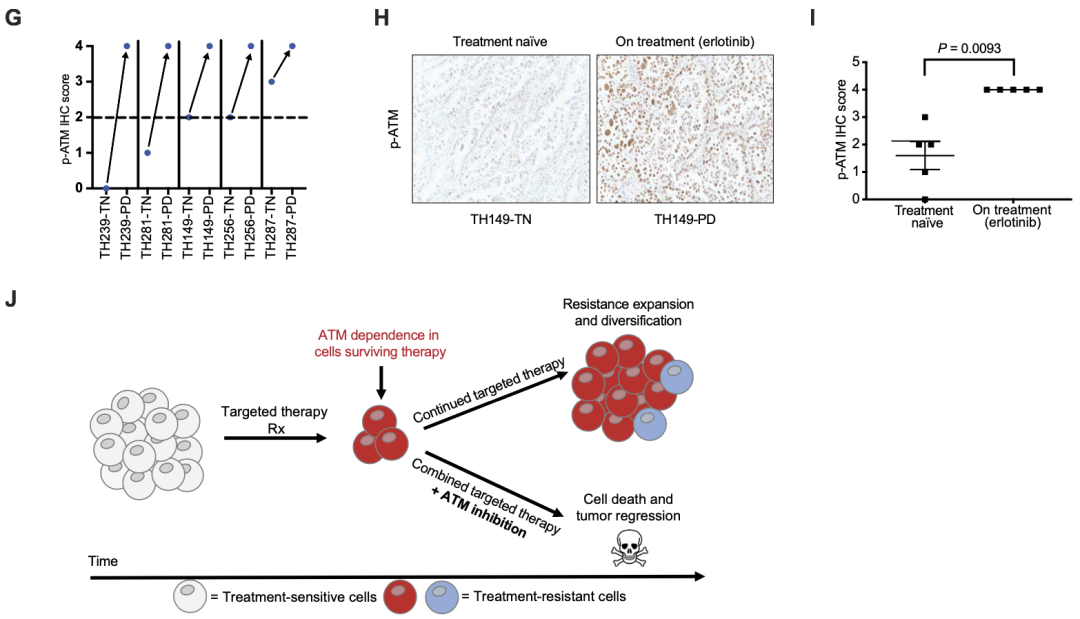
靶向治疗在患者肿瘤组织中诱导ATM激活
总的来说,这个研究探索了靶向治疗产生耐药性的分子机制,并通过体内外实验进一步验证了ATM抑制剂和靶向药物联合治疗对耐药肿瘤的清除效果,最后回归于临床,检测了NSCLC患者在靶向前后肿瘤组织中的表达情况,以及ATM功能缺失性突变对靶向药物疗效的影响。
这项研究为临床研发ATM抑制剂与现有靶向治疗方案的整合,以及临床试验设计奠定了理论基础,也为临床提供了新的诊疗思路。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


