孙倍成与林安宁研究团队合作揭示肝癌炎癌转化调控新机制
来源:南京大学 2021-05-29 12:56
南京大学医学院附属南京鼓楼医院孙倍成教授和南京大学现代生物研究院林安宁教授研究团队的最新成果,发现肝细胞中转录因子Miz1蛋白以不依赖于其转录功能的形式,通过与癌蛋白MTDH结合,阻断蛋白激酶IKK介导的MTDH的磷酸化,限制肝细胞转录因子NF-κB的促肿瘤活性,从而抑制化学性和炎症相关的肝细胞癌的发生和发展。肝细胞癌(HCC)是全球
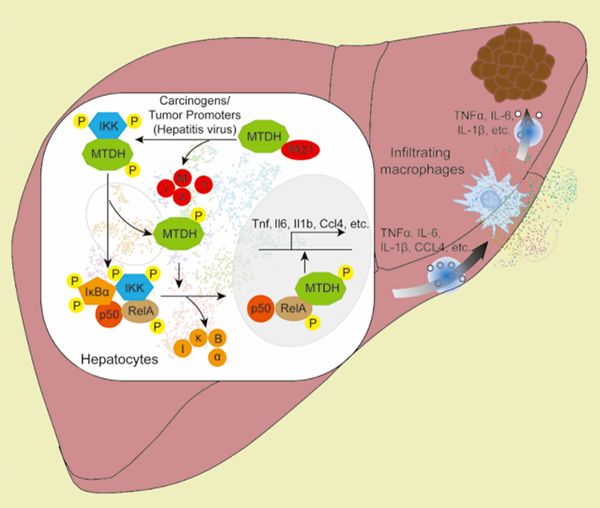
南京大学医学院附属南京鼓楼医院孙倍成教授和南京大学现代生物研究院林安宁教授研究团队的最新成果,发现肝细胞中转录因子Miz1蛋白以不依赖于其转录功能的形式,通过与癌蛋白MTDH结合,阻断蛋白激酶IKK介导的MTDH的磷酸化,限制肝细胞转录因子NF-κB的促肿瘤活性,从而抑制化学性和炎症相关的肝细胞癌的发生和发展。
肝细胞癌(HCC)是全球癌症相关死亡的第三大原因。慢性炎症与肝癌的发展有着直接的因果关系,是肝癌最重要的病理特征之一。多种病理因素,如HBV和HCV感染、饮酒、致癌基因、DNA损伤和肥胖,均能够诱导炎性肿瘤微环境,进而促进肝癌的发生发展。但是,肿瘤肝细胞与炎性肿瘤微环境的相互作用和调控机理尚不完全清楚。先前的研究证明转录因子NF-κB失活引起的肝细胞坏死(necrosis)促进炎性肿瘤微环境,进而刺激存活的肝细胞代偿性增殖,在化学性肝癌小鼠模型中促进肝癌的发展。可是,也有研究表明 NF-κB失活引起的肝细胞凋亡(apoptosis)在炎性介导的肝癌小鼠模型中却抑制肝癌的发生发展。有意思的是,虽然肝细胞NF-κB活性在HBV和HCV感染的肝癌病人中降低,但在近40%左右肝癌病人中反而增强。肝细胞NF-κB活性对肝癌的发生发展究竟是敌是友,至今尚无定论,影响了肝癌的有效治疗。
孙倍成和林安宁研究团队的最新研究结果证明,肝细胞NF-κB活性异常,无论是缺失或增高,通过不同分子机理都会诱导炎性肿瘤微环境,从而促进肝癌的发生发展。利用化学性DEN/CCl4以及炎性介导STZ/HFD诱导的两种不同的小鼠肝癌模型,通过单细胞测序深度分析肝癌微环境中肝癌细胞和巨噬细胞的相互作用,发现小鼠肝细胞中转录因子Miz1缺失,产生了高表达NF-κB下游炎症因子(TNF,IL1,IL6,CCL4等)的一类新颖的“炎性”肝细胞亚群,激活肿瘤浸润巨噬细胞向促炎表型转化,增强肝脏炎症反应,促进肝癌的发生发展。机制上,肝细胞胞浆中Miz1蛋白受到肿瘤坏死因子TNF诱导的蛋白水解调控,在人/鼠的肝癌进程中被诱导下调,从而释放了与结合Miz1的癌蛋白MTDH,增强了蛋白激酶IKK对MTDH的磷酸化,促进肝细胞中NF-κB的激活及其下游炎症因子的表达。有趣的是Miz1的这一机制并不依赖于其转录因子的功能。在相当一部分临床肝癌患者中,Miz1在肝癌组织中的低表达伴随着MTDH磷酸化的增强和分泌炎症因子肝细胞的增加。同时,Miz1蛋白的表达也被证实与肝癌患者的生存率和复发率密切相关,是独立的预后关联因素。
本研究基于多组学分析,利用多种体内、体外实验,揭示了肝细胞中Miz1蛋白缺失在肝癌发展过程中通过MTDH激活NF-κB、增强炎症的具体机制,提出了作为肝肿瘤主体的肝细胞驱动促癌炎症的重要假说,为肝癌患者的个性化治疗提供了新的理论基础。
该研究成果以The zinc finger protein Miz1 suppresses liver tumorigenesis by restricting hepatocyte-driven macrophage activation and inflammation为题发表于最新一期国际权威学术期刊Immunity。该工作由南京大学医学院附属南京鼓楼医院,南京大学现代生物研究院,美国芝加哥大学和中国科学院生物化学与细胞生物学研究所的研究人员共同完成。南京大学医学院附属南京鼓楼医院张文杰副主任医师,博士生张袁光炎和王飞为第一作者,孙倍成教授和林安宁教授为通讯作者。工作得到了科技部、国家自然科学基金委和NIH的经费支持。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


