2024年3月Science期刊精华
来源:生物谷原创 2024-04-02 09:30
发现褐藻和动物都存在雄性性别决定基因HMG-box、利用PACE平台构建出更小的蛋白降解标签,用于精确触发细胞天然蛋白的降解、中外科学家携手首次发现油菜素甾醇输出蛋白并破解它的三维结构
2024年3月份即将结束,3月份Science期刊又有哪些亮点研究值得学习呢?小编对此进行了整理,与各位分享。
1.Science:发现褐藻和动物都存在雄性性别决定基因HMG-box
doi:10.1126/science.adk5466
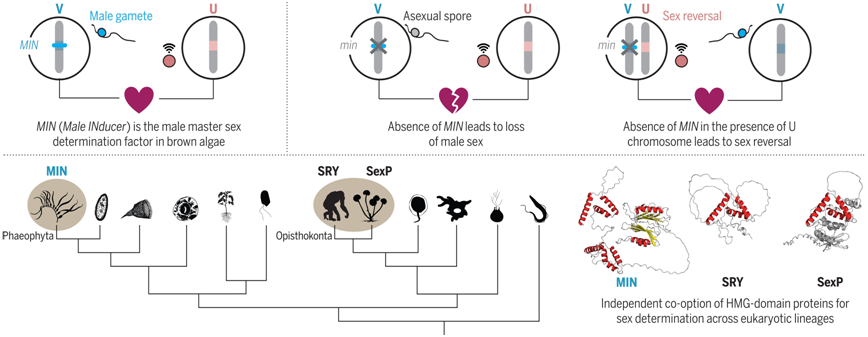
在一项新的突破性研究中,来自德国马克斯-普朗克生物研究所的研究人员证实褐藻(brown algae)中的一个 HMG-box 基因对决定雄性至关重要。这一突破极大地拓展了人们对真核生物性别决定机制的认识。迄今为止,只有少数脊椎动物和植物中的主性别决定基因被鉴定出来。相关研究结果发表在2024年3月22日的Science期刊上,论文标题为“Repeated co-option of HMG-box genes for sex determination in brown algae and animals”。
图片来自Science, 2024, doi:10.1126/science.adk5466
论文共同第一作者、马克斯-普朗克生物研究所藻类培养专家Rémy Luthringer博士解释说,“在自然栖息地,褐藻的配子会跳起令人着迷的交配舞蹈。雌配子会迅速固定在基质上,并在海水中释放一种类似化学信号的信息素来吸引雄配子。雄配子在雌配子‘香水味’的吸引下,利用两条鞭毛在雌配子周围绕圈逐渐靠近地游动。”
CRISPR/Cas技术通常被称为“基因剪刀”,随着这项技术的出现,这些作者可以精确地靶向并编辑褐藻的遗传物质。他们利用这一工具,通过产生功能缺失的突变体来测试 MIN 的生物功能。结果显而易见:CRISPR突变株中没有复杂的雄配子交配舞蹈。也就是说,在缺少MIN的情况下,雄配子对雌性信息素完全不敏感。
Coelho博士指出,“当我们敲除褐藻中的性别决定基因MIN时,并没有观察到性别逆转。相反,雄性变成了无性。这是因为它们缺少互补染色体,即雌性 U 染色体。这表明,U 染色体上的雌性诱导因子尚未被发现。”通过这些遗传实验,他们揭示了褐藻中雄性性别决定的复杂机制。
Coelho博士评论说,“将一个HMG-domain基因确定为褐藻的主性别因子,揭示了动物和海藻在决定雄性性别方面独立地趋同于相同的解决方案。”
2.Science:利用PACE平台构建出更小的蛋白降解标签,用于精确触发细胞天然蛋白的降解
doi:10.1126/science.adk4422
研究蛋白在健康和疾病中作用的科学家们使用实验工具使蛋白失活、破坏或阻止它们在细胞中产生。在一种方法中,人们用“消灭我”标签标记靶蛋白,这种标签与称为分子胶(molecular glue)的小分子一起作用,促使细胞自身的蛋白清除机制吞噬靶蛋白。然而,目前使用的许多标签太大,无法标记编码细胞天然蛋白的基因,或者会造成附带损害,引发除靶蛋白以外的蛋白破坏。
如今,在一项新的研究中,来自美国布罗德研究所的研究人员利用一种名为噬菌体辅助持续进化(phage-assisted continuous evolution, PACE)的平台生成了更小的蛋白降解标签,即锌指降解决定子(ZF degron)SD40,这类标签能形成分子胶水复合物,从而能够精确触发细胞自身蛋白的耗竭。相关研究结果发表在2024年3月15日的Science期刊上,论文标题为“Continuous evolution of compact protein degradation tags regulated by selective molecular glues”。

进化的锌指介导经过标记的内源性蛋白的特异性降解。图片来自Science, 2024, doi:10.1126/science.adk4422
这些作者随后利用他们之前开发的一种名为“先导编辑(prime editing)”的基因编辑技术,将紧凑的ZF degrron插入到人类细胞的基因组中,在那里,它招募了细胞蛋白破坏途径的关键组成部分,即cereblon(CRBN),并在一种其他方面惰性的小分子(新型IMiD衍生物,比如PT-179)的存在下,迅速诱导靶蛋白降解。
这些作者解析出CRBN•IMiD•ZF三组分复合物的三维结构,对它的活性和特异性提出新的见解,还进化出了能在小鼠细胞中发挥作用的ZF degrron变体。该平台有可能进化出更多新的ZF degrron和分子胶复合物,以便用于探索蛋白功能或验证治疗靶点。
论文共同通讯作者、布罗德研究所梅金医疗保健变革技术研究所主任David Liu说,“我们证实持续进化是一种强大的方法,可以快速进化出可成为有用的研究工具的分子胶系统。我们很高兴看到这种方法还能应用于进化以创造性和强大的方式与小分子相互作用的其他蛋白。”
3.Science:中外科学家携手首次发现油菜素甾醇输出蛋白并破解它的三维结构
doi:10.1126/science.adj4591
当你阅读这篇文章时,你的体内正有多种激素在辛勤工作,以稳定你的健康状况。正如人类一样,植物的生长和繁殖也离不开植物激素(phytohormone)的调节。其中一种植物激素是油菜素甾醇(brassinosteroid, BR),也被称为第六种植物激素。
在一项新的研究中,中国科学技术大学生命科学学院孙林峰(Sun Linfeng)教授课题组与 VIB-UGent 植物系统生物学中心的 Eugenia Russinova 教授及其团队发现了首个 BR 输出蛋白,并展示了它在底物未结合和BR结合两种状态下的结构。相关研究结果发表在2024年3月22日的Science期刊上,论文标题为“Structure and function of the Arabidopsis ABC transporter ABCB19 in brassinosteroid export”。
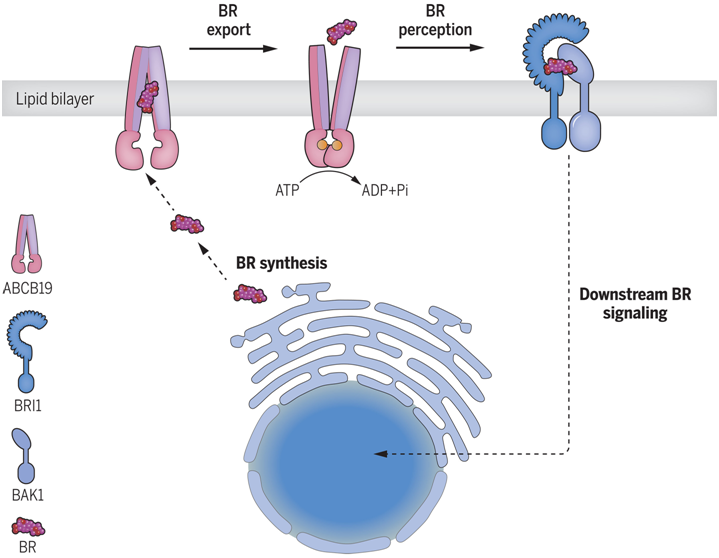
植物BR激素输出和信号传导模型。图片来自Science, 2024, doi:10.1126/science.adj4591
这种新发现的BR输出蛋白——ABCB19,过去通常被认为是另一种重要植物激素——生长素(auxin)的转运蛋白。然而,ABCB19 的突变体表型与典型的生长素转运蛋白并不完全一致。在此基础上,这些作者提出了一个大胆的问题:ABCB19 是否有生长素以外的底物。
这些作者寻找各种证据来验证他们的假设。他们首先测试了拟南芥 ABCB19 在不同植物激素(包括生长素和BR)作用下的 ATPase 活性。他们的结果表明,ABCB19 的 ATPase 活性可受到生物活性BR剂量依赖性的刺激,但不会受到生长素或BR生物合成前体的刺激。与此同时,他们还进行了体外和体内测试来评估 ABCB19 转运BR的情况。
4.Science:新研究揭示急性压力引起的泛化恐惧(例如PTSD)是由于神经元中的神经递质转换引起的
doi:10.1126/science.adj5996
我们的神经系统天生就能感知恐惧。无论是我们在黑暗中独自听到的阴森恐怖的声音,还是威胁性动物的咆哮声,我们的恐惧反应都是一种生存机制,它告诉我们要保持警惕,避免危险情况的发生。但是,如果在没有实际威胁的情况下产生恐惧,就会对我们的健康造成危害。那些曾经遭受过严重或危及生命的压力的人,即使在没有实际威胁的情况下,也会产生强烈的恐惧感。这种泛化的恐惧感会对心理造成伤害,并可能导致长期的精神疾病,如创伤后应激障碍(post-traumatic stress disorder, PTSD)。
导致我们大脑在没有威胁的情况下产生恐惧感的压力诱导机制一直是个谜。如今,在一项新的研究中,来自美国加州大学圣地亚哥分校的研究人员确定了导致这种泛化的恐惧体验的大脑生化变化,并绘制了神经回路图。这一发现为如何预防恐惧反应提供了新的见解。相关研究结果发表在2024年3月15日的Science期刊上,论文标题为“Generalized fear after acute stress is caused by change in neuronal cotransmitter identity”。
图片来自Science, 2024, doi:10.1126/science.adj5996
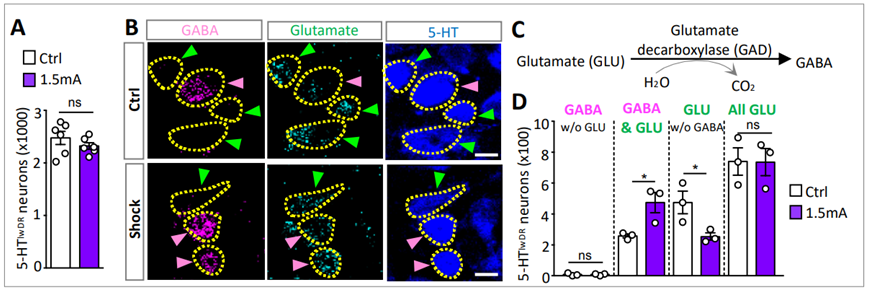
在这项新的研究中,加州大学圣地亚哥分校前助理项目科学家Hui-quan Li、生物科学学院教授Nick Spitzer和他们的同事们描述了他们发现神经递质——让大脑神经元相互沟通的化学信使,是压力诱发性泛化恐惧(stress-induced generalized fear)的根源的研究过程。
通过研究小鼠大脑中一个称为背侧缝(dorsal raphe)的区域(位于脑干),他们发现,急性压力会诱导神经元中化学信号的转换:从兴奋性神经递质谷氨酸转换为抑制性神经递质γ-氨基丁酸(GABA),从而导致泛化恐惧反应。
Spitzer说,“我们的研究结果为了解恐惧泛化的相关机制提供了重要启示。从分子细节这一层面了解这些过程的益处,包括到底发生了什么以及发生在哪里,允许我们针对相关疾病的驱动机制进行干预。”
5.Science:重大突破!开发出更高效制造人类人工染色体的新技术
doi:10.1126/science.adj3566
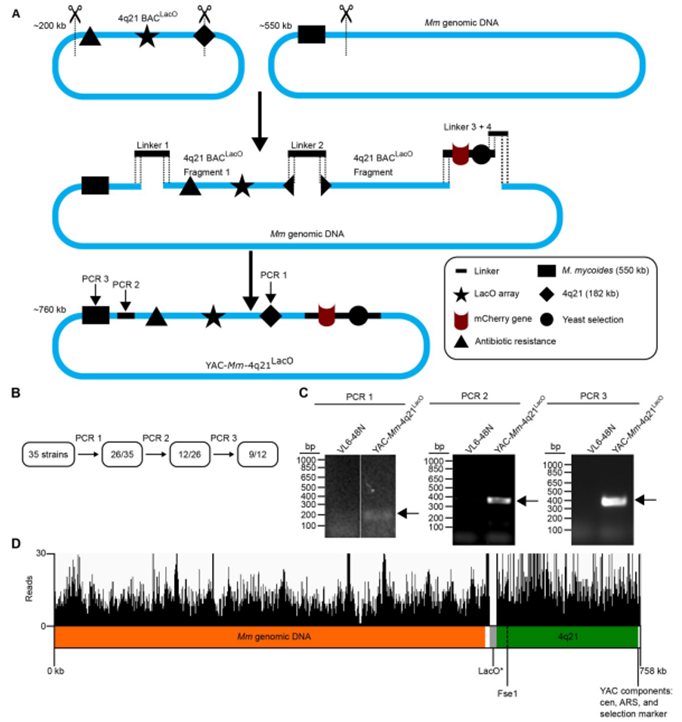
如今,在一项新的研究中,来自美国宾夕法尼亚大学佩雷尔曼医学院等研究机构的研究人员在这一领域取得了重大突破,有效地绕过了一个常见的绊脚石。他们设计出一种利用单个较长的设计DNA(designer DNA)构造体来制造HAC的高效技术。相关研究结果发表在2024年3月22日的Science期刊上,论文标题为“Efficient formation of single-copy human artificial chromosomes”。
图片来自Science, 2024, doi:10.1126/science.adj3566
以前制造HAC的方法一直受限于这样一个事实,即用于制造HAC的DNA构造体往往以不可预测的长系列和不可预测的重排连接在一起,即多聚化。这种新方法可以更快、更精确地制造 HAC,从而直接加快 DNA 研究的速度。假以时日,再加上有效的递送系统,这项技术就能为癌症等疾病带来更好的工程化细胞疗法。
在这项新的研究中,这些作者通过多种创新设计出了改进的 HAC,包括包含更大、更复杂着丝粒的更大初始 DNA构造体,这使得 HAC 可以利用单个这样的DNA构造体形成。在向细胞递送时,他们使用了一种能够携带更大货物的基于酵母细胞的递送系统。
6.Science:新研究确定人类GBP1免疫防御复合体的天然三维结构
doi:10.1126/science.abm9903
在一项新的研究中,来自美国耶鲁大学的研究人员发现了一个免疫蛋白家族,他们将其描述为“巨大的分子机器”,可能会影响我们身体对抗感染的方式。相关研究结果发表在2024年3月1日的Science期刊上,论文标题为“Native architecture of a human GBP1 defense complex for cell-autonomous immunity to infection”。
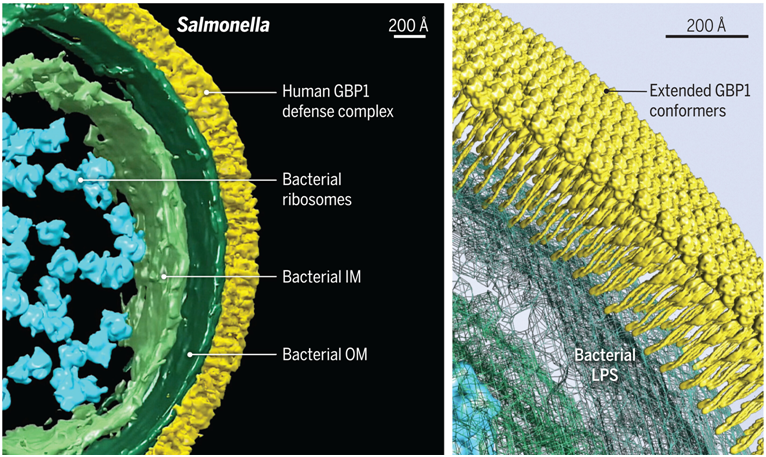
人类GBP1防御复合体的结构。图片来自Science, 2024, doi:10.1126/science.abm9903
这些作者利用最新的低温电镜技术观察人体细胞内部,发现了一个大型免疫蛋白家族,该蛋白家族中的这些蛋白直接在微生物病原体表面上组装成一个巨大的信号传导平台。这一发现是朝着了解宿主-病原体平台是如何启动和组装的,以及利用它控制感染的新医学应用潜力迈出的重要一步。
鸟苷酸结合蛋白(Guanylate Binding Protein, GBP)是MacMicking团队十多年前发现的细胞内宿主防御的主要组织者。它们为宿主提供保护,使其免受动物和植物中存在的一系列细菌、病毒或寄生虫的侵害。但是在此之前,大多数光学显微镜和传统电子显微镜都限制了科学家们以相对较低的分辨率研究生物样本。
这些作者利用新的低温电镜技术——该技术使得人们能够有效地冷冻整个活细胞,并将其置于电子束下,以捕捉断层图像中的高分辨率结构,观察到GBP聚集在进入细胞质的病原体表面上。他们发现数千个GBP在细菌周围形成了一层盔甲(GBP1外壳复合体),使得其他防御蛋白能够识别和杀死被包裹的细菌,并动员免疫细胞进行保护。
7.Science:工业化社会或会让人类失去健康的肠道微生物
doi:10.1126/science.adj9223
近日,一篇发表在国际杂志Science上题为“Cryptic diversity of cellulose-degrading gut bacteria in industrialized humans”的研究报告中,来自以色列本-古里安大学等机构的科学家们通过研究发现,工业化社会或许正在让我们失去健康的肠道微生物,其会明显影响机体的肠道菌群,因为研究结果显示,降解纤维素的细菌正在从人类机体的肠道微生物组组消失。
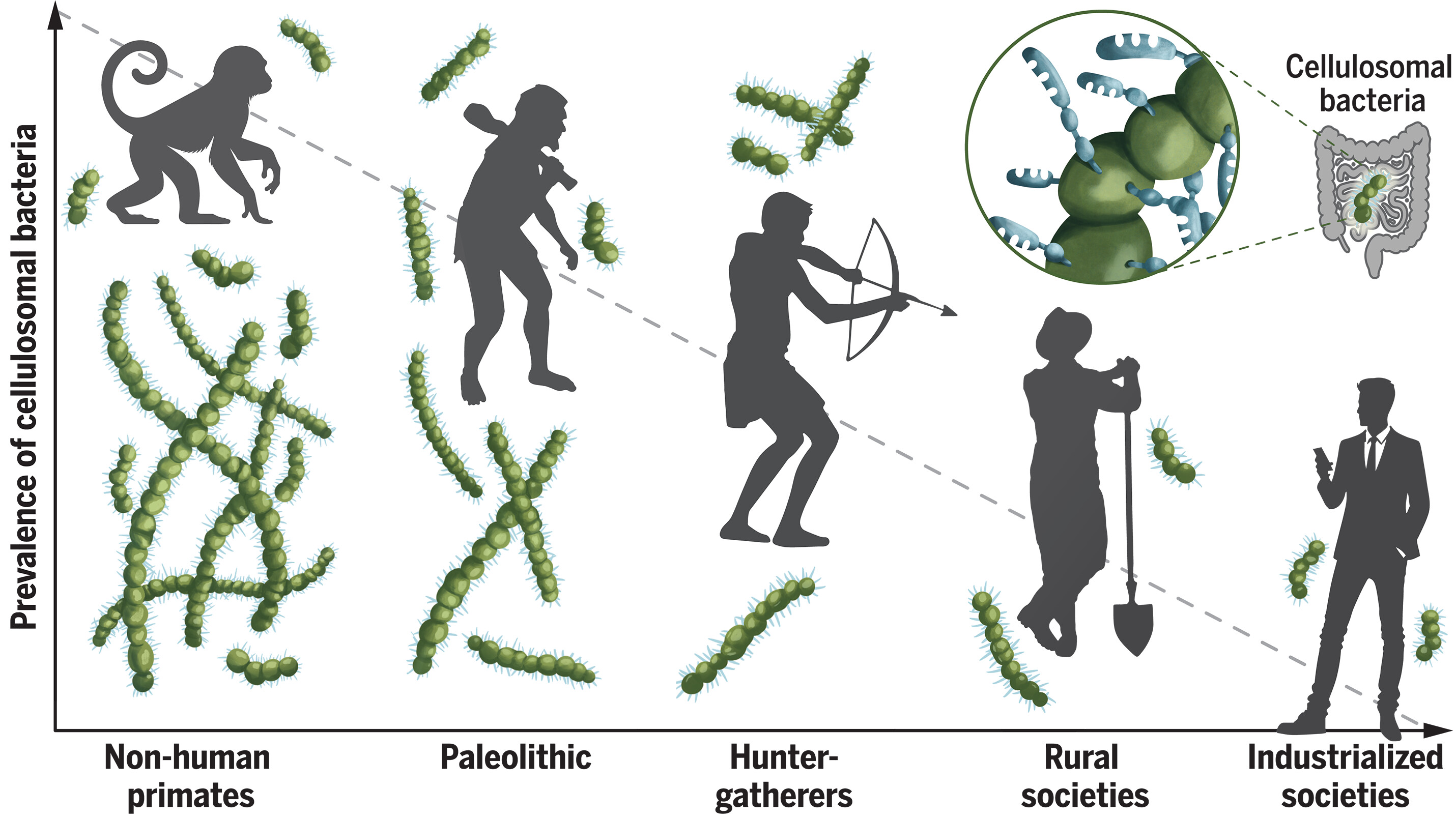
工业化社会或会让人类失去健康的肠道微生物。图片来源:Science (2024). DOI:10.1126/science.adj9223
研究者Sarah Morais说道,在整个人类进化过程中,纤维一直是人类饮食的主要组成部分,其同时也是灵长类祖先饮食的主要成分,能维持机体肠道菌群的健康。文章中,我们识别出了人类肠道微生物组的重要新成员,即一种名为的瘤胃球菌属(Ruminococcus)的纤维素降解细菌,这些细菌能通过产生称之为纤维素体(cellulosomes)的大而高度特异化的细胞外蛋白复合体,从而来降解纤维素。降解纤维素并不是一件容易得事情,很少有细菌能完成这项任务,纤维素因其不溶性很难被消化,肠道中的纤维就好像游泳池中的树干一样,其会被变湿但不会被溶解。
人群抽样结果表明,在人类狩猎采集社会和农村人类社会中,瘤胃球菌属确实是人类肠道微生物组的强大组成部分,但在工业化社会的人类样本中,瘤胃球菌属很少或者会发生缺失。研究者William Martin表示,20万年前我们在非洲的祖先并不会在汽车外卖店购买午餐,也不会食用快餐,而如今在西方社会中,这种情况的确会大规模地发生。
doi:10.1126/science.adi8081
在一项新的研究中,来自美国麻省理工学院的研究人员发现了一种驱动发声的大脑回路,它能确保你只在呼气时说话,吸气时停止说话。这种新发现的回路控制着发声所需的两个动作:缩小喉部和从肺部呼出空气。他们还发现这种发声回路受一个调节呼吸节奏的脑干区域的指挥,从而确保呼吸仍然主导说话。相关研究结果发表在2024年3月8日的Science期刊上,论文标题为“Brainstem control of vocalization and its coordination with respiration”。
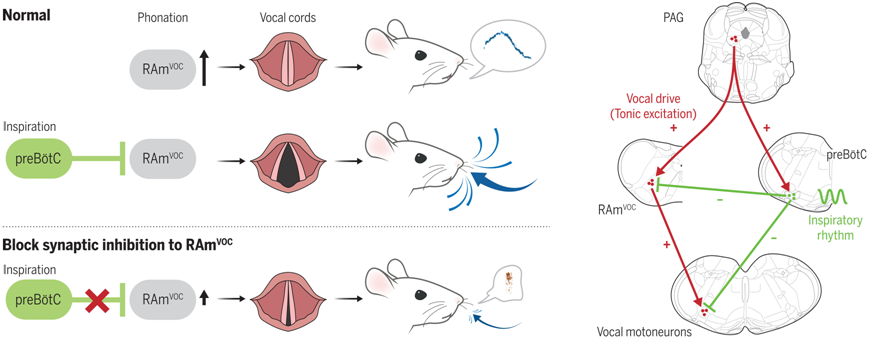
负责发声和发声-呼吸协调的神经元和回路机制。图片来自Science, 2024, doi:10.1126/science.adi8081
论文共同通讯作者、麻省理工学院大脑与认知科学教授Fan Wang说,“当你需要吸气时,就必须停止发声。我们发现,控制发声的神经元会直接接收来自呼吸节奏发生器(breathing rhythm generator)的抑制性输入。”
这些作者着重利用小鼠模型研究大脑如何控制这一发声过程。小鼠使用称为超声波发声(ultrasonic vocalizations, USV)的声音相互交流,它们使用独特的口哨机制,通过几乎闭合的声带之间的一个小孔呼出空气。Wang说,“我们想了解控制声带内收的神经元是什么,这些神经元又是如何与呼吸回路相互作用的?”
为了弄清这个问题,这些作者使用了一种可以绘制神经元之间突触连接图的技术。他们知道声带内收是由喉运动神经元控制的,因此他们首先向后追踪,找到支配这些运动神经元的神经元。他们发现,一个主要的输入源是位于一个称为疑核后核(retroambiguus nucleus, RAm)的后脑区域的一组前运动神经元(premotor neuron)。之前的研究表明,这一区域参与了发声,但人们并不知道究竟RAm的哪一部分是所必需的,也不知道它是如何实现发声的。
这些作者发现,这些突触追踪标记的 RAm 神经元在 USV 期间被强烈激活。这一观察结果促使他们使用一种依赖于活动的方法来靶向这些发声特异性 RAm 神经元,即RAmVOC。他们利用化学遗传学和光遗传学来探索如果抑制或刺激它们的活动会发生什么。
当他们阻断RAmVOC神经元时,小鼠不再能发出 USV 或任何其他类型的声音。它们的声带没有闭合,腹部肌肉也没有收缩,而在呼气发声时它们通常会这样做。相反,当RAmVOC神经元被激活时,小鼠的声带闭合,呼气,并发出 USV。然而,如果刺激持续两秒钟或更长时间,这些USV就会因吸气而被中断,这表明这一过程是在大脑调节呼吸的同一部位控制下进行的。
9.Science:科学家识别出对于触觉感知非常重要的新型离子通道
doi:10.1126/science.adl0495
每一次拥抱,每一次握手,每一个灵巧的动作都需要触觉感知,因此,理解触觉发生背后的分子基础就显得尤为重要。到目前为止,研究人员已经知道,名为Piezo2的离子通道是触觉感知所必需的,但很明显,这种蛋白质本身并不能解释机体整个触觉感知。
近日,一篇发表在国际杂志Science上题为“Touch sensation requires the mechanically-gated ion channel ELKIN1”的研究报告中,来自德国的科学家们通过研究发现了在触觉感知过程中扮演重要角色的新型离子通道。
20多年来,研究者Gary Lewin一直在研究触觉发生背后的分子机制,如今他们发现了名为Elkin1的离子通道或许在触觉感知过程中扮演着关键角色,这只是参与触觉感知的第二个离子通道,这种蛋白质很有可能会直接参与机械刺激(比如轻轻触摸)转化为电信号的过程。当Elkin1存在时,皮肤上的受体就会通过神经纤维将触觉信号传输到中枢神经系统和大脑中。
研究人员培育了缺失Elkin1基因的遗传修饰小鼠,随后他们进行了简单的行为实验,利用棉签来轻轻擦拭啮齿类动物的后爪,Lewin博士表示,通常情况下,正常小鼠有90%的时间能对棉签产生反应,相比之下,缺乏Elkin1的小鼠仅有一半时间会产生反应,这就表明了触觉不敏感,重要的是,啮齿类动物对诸如温度等非机械刺激的反应并未受到影响。
在神经元层面上,研究人员利用膜片钳(patch clamp)法来记录感觉神经元在神经元膜被戳时所产生的电活性,在缺乏Elkin1遗传修饰的小鼠中,大约有一半的神经元并不会对机械信号产生反应,也不会存在信号传递发生。进一步的实验结果表明,在信号从皮肤到脊髓和大脑的第一段路程中,并不会有信号从神经元的受体传递到皮肤中。
此外,研究人员通过联合研究分析了在来自干细胞的人类感觉神经元培养物中,Elkin1是否对于触觉的传导是必要的?相关研究结果也有力地表明,Elkin1在人类触觉感知过程中发挥着潜在的重要作用。
10.Science:科学家识别出所有哺乳动物脑细胞共有的学习和记忆基因的新型调节功能
doi:10.1126/science.adk1291
近日,一篇发表在国际杂志Science上题为“SynGAP regulates synaptic plasticity and cognition independently of its catalytic activity”的研究报告中,来自约翰霍普金斯大学医学院等机构的科学家们通过研究识别出了一种能控制哺乳动物(包括小鼠和人类)记忆和学习能力的特殊DNA序列(SYNGAP1基因)的新功能。
相关研究结果或会影响为携带SYNGAP1突变的儿童设计的新型疗法的开发,这类儿童往往患有一系列以智力残疾、自闭症样行为和癫痫行为为特征的神经发育障碍。一般而言,SYNGAP1和其它基因一样,能通过制造调节突触(脑细胞之间的连接)强度的蛋白质来控制机体的学习和记忆能力。
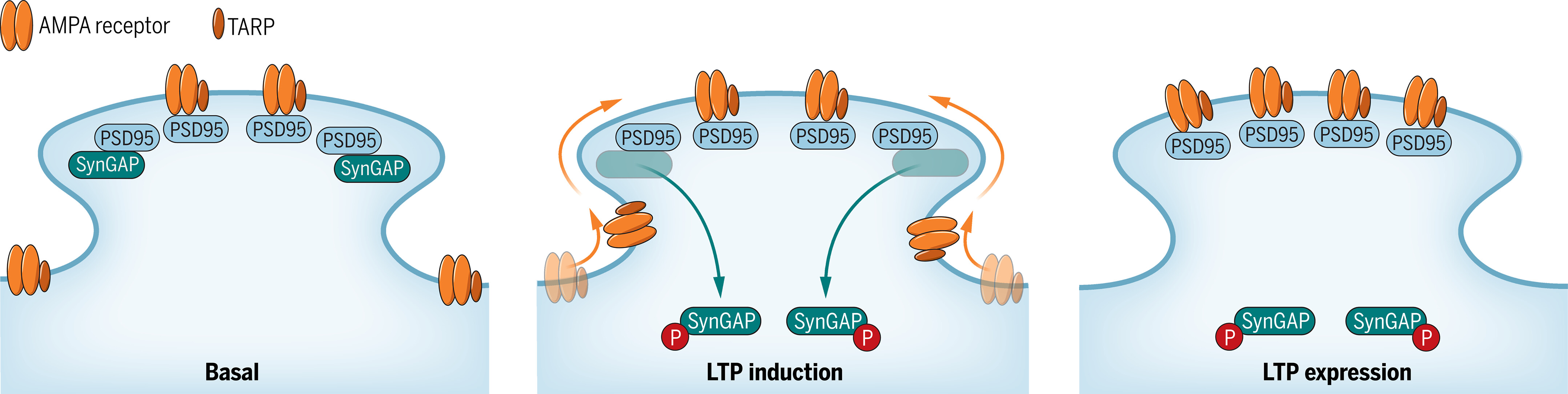
科学家识别出所有哺乳动物脑细胞共有的学习和记忆基因的新型调节功能。图片来源:Science (2024). DOI:10.1126/science.adk1291
研究者Richard Huganir教授及其团队于1998年首次分离到了SYNGAP1基因,SynGAP蛋白在突触中非常丰富,长期以来研究人员认为其主要作用是引发调节突触强度的酶化学反应,但当对SynGAP蛋白进行研究后,研究人员开始观察到,SynGAP蛋白在与主要的突触支架蛋白PSD-95相互作用时就会具有一种奇怪的特性,其会转变成液滴状,对于酶类蛋白而言,这种结构的转变是不寻常的。
为了阐明并理解SynGAP发生特殊液体转化的目的,研究人员对神经元进行实验,在SYNGAP1基因中所谓的GAP结构域中插入了突变,这种突变在不影响蛋白质结构的情况下会移除SynGAP的酶功能,随后研究者发现,即使没有酶类活性,突触也能正常发挥作用。这就表明,结构特性本身对于SynGAP的功能而言尤为重要。接下来研究人员在小鼠机体中进行了相同的遗传工程化修饰——移除SynGAP的酶功能,结果发现了相似的结果,突触的行为会变得正常,并且具有良好的可塑性,小鼠在学习和记忆行为上也不会表现出困难,这就表明,SynGAP的结构特性足以维持机体正常的认知行为。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


