CD:中国科学家打破肝癌免疫治疗耐药困境!复旦大学樊嘉院士/朱棣/徐泱团队揭示IFN-α增强抗PD-1治疗机制
来源:奇点糕 2022-04-29 16:04
在全球范围内,肝脏肿瘤(肝细胞癌,HCC)发生率持续增加,成为危害公共健康的重要因素[1]。有预测显示,在2025年以前,每年将有超过一百万新增HCC患者[2]。
在全球范围内,肝脏肿瘤(肝细胞癌,HCC)发生率持续增加,成为危害公共健康的重要因素[1]。有预测显示,在2025年以前,每年将有超过一百万新增HCC患者[2]。世界卫生组织国际癌症研究机构发布的数据显示,2020年我国HCC发生率高居世界第八位,而在我国所有癌症中,HCC发病率位居第五位,死亡率位居第二位,HCC的防控及治疗刻不容缓!
在过去的五年中,免疫检查点抑制剂(ICI)为HCC治疗带来了巨大的变革。相较于传统的HCC一线治疗药物索拉非尼,多种联合治疗方案,如阿替利珠单抗(PD-L1)和贝伐珠单抗(VEGF-A)的联合治疗、度伐利尤单抗(PD-L1)和Tremelimumab(CTLA-4)的联合治疗、阿替利珠单抗和Cabozantinib(多靶点酪氨酸酶抑制剂)的联合治疗等等,均取得了更好的治疗效果。除此之外,纳武利尤单抗(PD-1)和伊匹木单抗(CTLA-4)的联合治疗方案、帕博利珠单抗(PD-1)的单一治疗方案更是因其出色的早期临床数据,进入美国食品药品监督管理局(FDA)的快速审批通道[3]。
然而,亚洲的HCC患者对ICI治疗方案的客观响应率(ORR)并不理想[4],因此,了解HCC免疫抑制微环境具有极其重要的意义,如何打破免疫治疗耐受,并开发新型免疫治疗方案成为重中之重。
近日,复旦大学附属中山医院樊嘉院士、复旦大学基础医学院药理学系朱棣,以及复旦大学附属中山医院徐泱团队合作,在著名期刊Cancer Discovery发表重要研究成果。

他们利用HCC患者的临床研究和小鼠HCC模型,发现干扰素(IFN)-α通过调控HCC细胞中FosB的转录活动,抑制缺氧诱导因子HIF1α,从而抑制HCC细胞糖酵解,降低对葡萄糖的摄取,重塑并形成富含葡萄糖的肿瘤微环境(TME);高葡萄糖的TME 促进T细胞mTOR-FOXM1信号通路活化,使肿瘤浸润CD8+T细胞高表达共刺激分子CD27,增强其杀伤功能,放大PD-1阻断对HCC的治疗效果[5]。更重要的是,IFN-α+PD-1阻断联合治疗方案在HCC患者中具有较高的响应率,并显著抑制HCC的疾病进展。
他们的研究成果为开辟HCC新型免疫治疗方案提供了坚实可靠的理论基础,其取得的前期临床试验成果令人兴奋不已!复旦大学附属中山医院胡博主治医师、中山医院喻敏成博士研究生、中山医院马晓路博士、中山医院孙嘉磊博士研究生、药学院刘成龙博士研究生为该文共同第一作者。
接下来咱们就一起看看,樊嘉院士/朱棣/徐泱团队是如何探索IFN-α+PD-1阻断对HCC的治疗效果及其背后的免疫学机制。
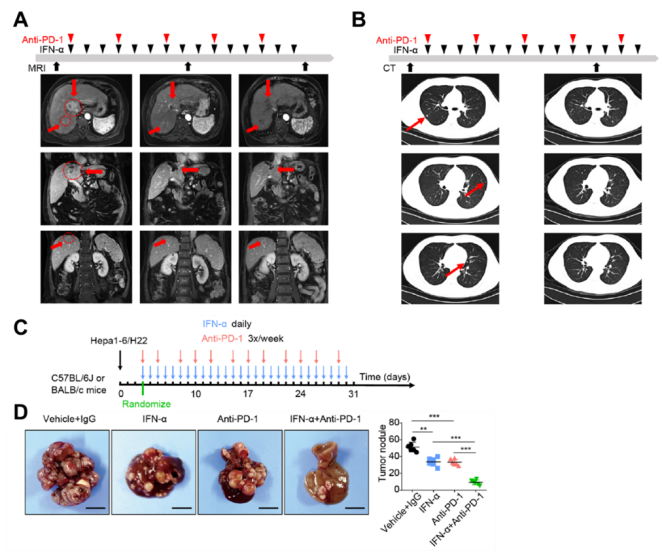
IFN-α+PD-1阻断联合治疗显著抑制肿瘤发生发展
为了观察IFN-α+PD-1阻断的联合治疗效果,研究人员观察了15例无法进行手术切除的肝癌患者,并给予IFN-α+PD-1阻断联合治疗。令人惊讶的是,联合治疗后ORR为40.0%,疾病控制率(DCR)高达80.0%,同时没有出现因治疗导致的死亡病例。
其中1号患者是一名67岁的女性,曾做过动脉插管化疗栓塞术(TACE),并随后接受PD-1阻断治疗,但是临床反应较小,最终导致疾病持续加重。该患者肝脏中最大的肿瘤 (2.3×4.1 厘米)位于 VIII 节段,靠近肝门静脉分支。然而,经过7周的IFN-α+PD-1阻断联合治疗后,该患者的肿瘤出现坏死,其体积显著变小。在后期的随访观察中,该患者的肿瘤大小也未增加,同时也没有出现副作用。
2号患者是一名34岁的男性,其肝癌十分巨大。该患者经过多次TACE治疗和两次肝切除,随后也接受PD-1阻断治疗。在治疗后的一年内,该患者并未出现明显的肝癌复发迹象。但两年后,该患者出现呼吸困难的症状,经CT检测发现,肺脏出现10个以上的肿瘤转移灶。值得庆幸的是,经过两个月的IFN-α+PD-1阻断联合治疗后,CT检测发现该患者肺脏中的多个肿瘤转移灶被完全清除,同时最大的肿瘤结节(1.4厘米)显著缩小,也没有出现新的转移灶。
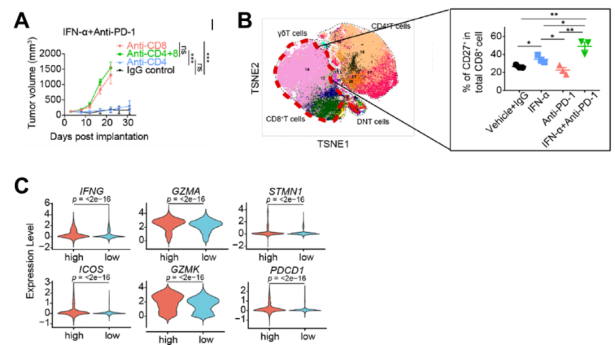
IFN-α+PD-1阻断联合治疗促进CD27+CD8+T细胞比例
为了探究IFN-α+PD-1阻断联合治疗方案的免疫学机制,研究人员利用肝癌细胞系Hepa1-6细胞和H22细胞构建原位同基因小鼠肝癌模型。结果发现,相较于IFN-α或PD-1阻断等单一治疗,IFN-α+PD-1阻断联合治疗能够显著抑制肿瘤的发生发展,同时,荷瘤小鼠生存期明显延长。更重要的是,IFN-α+PD-1阻断联合治疗能够诱导肿瘤坏死,进而完全清除肺脏中的转移灶。进一步分析发现IFN-α+PD-1阻断联合治疗依赖健全的免疫系统,同时IFN-α直接作用于表达其受体(IFNAR1)的HCC细胞。
为了解IFN-α+PD-1阻断联合治疗对TME中浸润的免疫细胞的影响,研究人员分离肿瘤组织中的CD45+免疫细胞,并使用质谱流式(CyTOF),检测了42种细胞表面或胞内的免疫指标。结果发现,IFN-α+PD-1阻断联合治疗能够显著降低耗竭CD8+T细胞前体的数量。
接下来,研究人员对Hepa1-6荷瘤小鼠进行了CD4+T细胞和CD8+T细胞的清除实验。结果发现CD8+T细胞在其中发挥了重要作用。结合CyTOF和多色免疫荧光的检测结果,研究人员观察到经过IFN-α+PD-1阻断联合治疗后,肿瘤组织中CD27+CD8+T细胞亚群的数量显著增加。除此之外,研究人员将HCC患者培育的类器官(PDO)与自体的肿瘤浸润免疫细胞共培养,也观察到了类似的现象,即IFN-α+PD-1阻断联合处理能够在最大程度上增加CD8+T细胞上CD27的表达。
那么,CD27表达是否能够促进CD8+T细胞的抗肿瘤功能呢?为此,研究人员利用Cd27特异性的siRNA,敲低肿瘤浸润CD8+T细胞上CD27的表达。与预期的一致,CD27下降后,CD8+T细胞分泌炎性细胞因子和细胞毒性颗粒的能力显著降低。同时,HCC患者肿瘤组织的单细胞测序结果也证实,CD27highCD8+T细胞上细胞毒性和增殖相关的基因表达水平也明显增加。有趣的是,HCC患者肿瘤组织中的CD27highCD8+T细胞上PD-1的表达亦高于CD27lowCD8+T细胞。
以上结果暗示CD27+CD8+T细胞亚群可能在IFN-α+PD-1阻断联合治疗的过程扮演了重要角色。
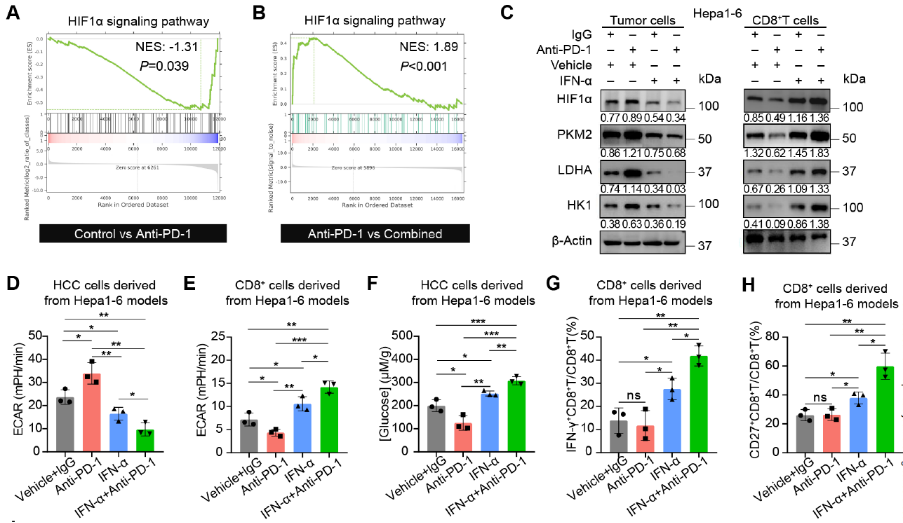
IFN-α+PD-1阻断联合治疗抑制肿瘤细胞糖酵解
基因集富集分析(GSEA)和免疫印迹实验均证实,阻断PD-1会促进肿瘤细胞中的HIF1α信号通路,然而,联合治疗则显著抑制HIF1α信号通路。与肿瘤细胞相反的是,肿瘤浸润CD8+T细胞在经过PD-1阻断后,HIF1α及其下游分子的表达有所下降,而IFN-α+PD-1阻断联合处理则会起到相反的结果,导致CD8+T细胞摄取葡萄糖的能力增强,从而促进其增殖和活化。
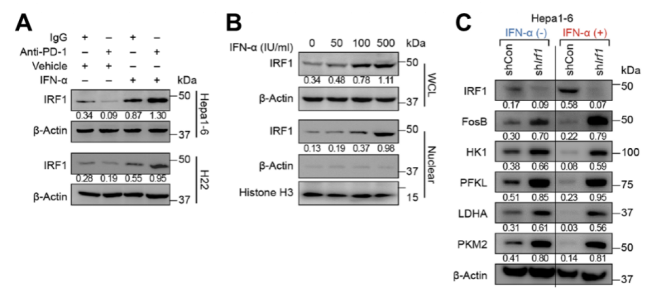
IFN-α通过IRF1-FosB信号轴负调HIF1α
HIF1α在糖酵解过程中发挥了重要作用,因此研究人员进行了细胞外酸化率(ECAR)实验。与HIF1α信号通路的变化一致,阻断PD-1能够促进肿瘤细胞糖酵解,而IFN-α+PD-1阻断联合处理会显著抑制肿瘤细胞糖酵解。在CD8+T细胞中得到了截然相反的结果。并且,阻断PD-1后,TME中葡萄糖含量明显降低,而IFN-α处理则会逆转这一变化。
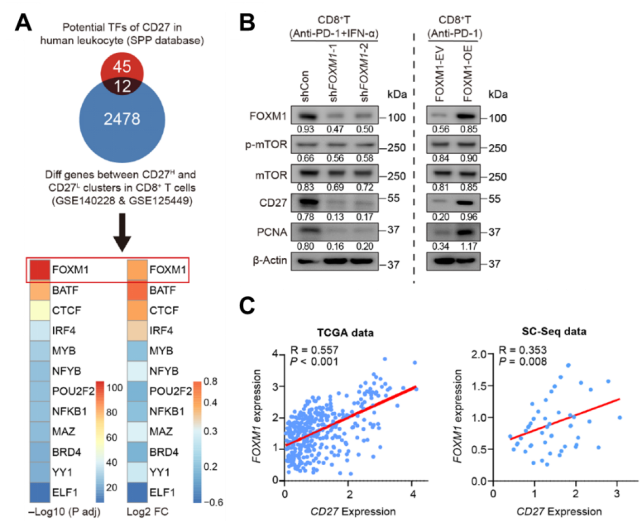
IFN-α+PD-1阻断联合治疗活化mTOR-FOXM1信号通路
深入研究发现IFN-α处理会促进肿瘤细胞中转录因子IRF1的表达,并使其向核内聚集,继而抑制促癌基因FosB的表达,而FosB会与HIF1α结合,导致HIF1α无法继续促进糖酵解相关基因的表达,如Pfkl,Hk1,Pkm2和Ldha等等,最后造成肿瘤细胞糖酵解能力下降,形成葡萄糖含量变高的TME。
TME中葡萄糖含量越高,CD8+T细胞中p-mTOR、HIF1α、PKM2、LDHA和CD27等分子的蛋白水平越高,并且,这一过程依赖mTOR信号通路。为了研究mTOR对CD27的调控作用,研究人员利用信号通路计划(SPP)数据库,预测人白细胞中调控CD27的转录因子,并与单细胞数据进行整合分析。发现CD27highCD8+T细胞高表达FOXM1。虽然在稳态下,CD8+T细胞过表达Foxm1,不能增加CD27+CD8+T细胞的比例,但会显著促进CD8+T细胞分泌IFN-γ和IL-2。
有意思的是,CD8+T细胞中FOXM1的表达在IFN-α处理后会明显增加,而IFN-α+PD-1阻断联合处理则会进一步放大这一现象。除此之外,高葡萄糖培养基也会促进FOXM1表达。相反的是, mTOR抑制剂或HIF1α抑制剂则会逆转FOXM1的表达。
随后,研究人员用IFN-α+PD-1阻断联合治疗荷瘤小鼠,并分离肿瘤浸润的CD8+T细胞,过表达和敲低实验均证实FOXM1能够促进CD8+T细胞表达CD27。除此之外,研究人员在HCC的TCGA数据库和单细胞测序数据中也看到了类似的现象,即CD27和FOXM1表达水平呈明显正相关。
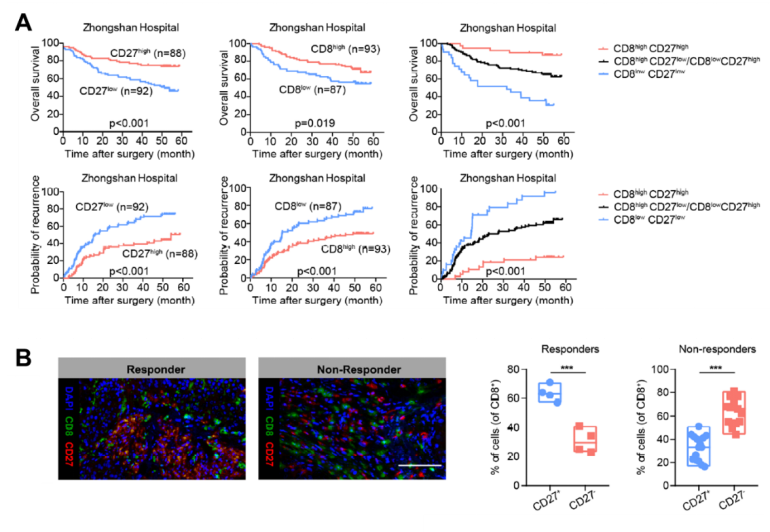
CD27和CD8是HCC患者良好预后的重要指标
以上结果证实IFN-α+PD-1阻断联合治疗会重塑TME,使得微环境中葡萄糖含量增加,激活CD8+T细胞中的mTOR信号通路,提高FOXM1表达水平,从而增强Cd27转录。
最后研究人员对HCC患者进行生存期预后分析,发现CD27highCD8high的细胞越多,患者的无进展生存期和总生存期越长,预后也越好。不仅如此, HCC患者经过PD-1阻断治疗后,有响应的患者往往存在更多的肿瘤浸润CD27+CD8+淋巴细胞。
总的来说,樊嘉院士/朱棣/徐泱的研究团队发现,IFN-α+PD-1阻断联合治疗能够显著抑制肝癌小鼠或HCC病人中的肿瘤生长。深入研究证实,IFN-α会诱导HCC细胞中IRF1表达,继而抑制FosB转录,导致HIF1α的转录活动被抑制,使得HCC细胞糖酵解能力下降,重塑TME。富含葡萄糖的TME又会活化CD8+T细胞的mTOR-FOXM1信号通路,导致共刺激分子CD27表达增加,促进CD8+T细胞的肿瘤免疫监视功能。
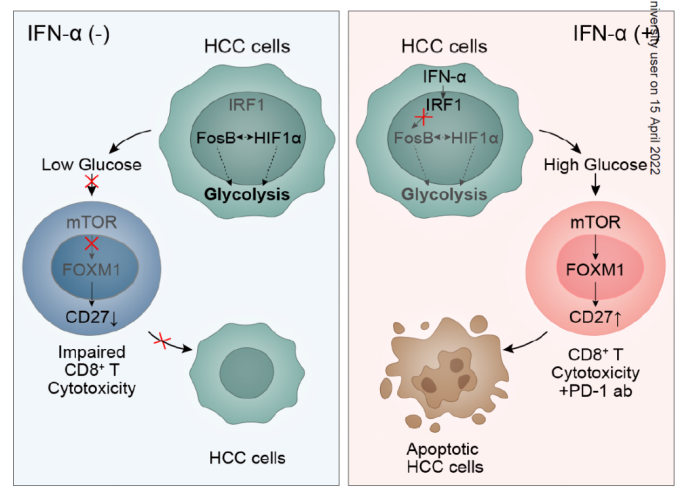
文章内容总结图
樊嘉院士及其团队任重而道远,他们设计的IFN-α+PD-1阻断联合治疗方案仍不成熟,比如,应扩大HCC临床患者群体,以检验IFN-α+PD-1阻断联合治疗的临床价值;需要系统性评估该治疗方案的不良反应;同时,还应探索IFN-α+PD-1阻断联合治疗对其它类型肿瘤的治疗效果。
但是,毫无疑问,樊嘉院士/朱棣/徐泱团队推出的IFN-α+PD-1阻断联合治疗方案振奋人心、令人激动!他们的初期临床试验和小鼠动物模型得到的效果也十分显著、意义重大!希望后续的相关临床试验也同样出色,为肿瘤的免疫学治疗做出里程碑式的贡献,也为广大肿瘤患者带来真正的希望!
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


