也从最新JAMA Oncology综述,看晚期肝癌免疫联合治疗选择,延长 OS 才是唯一要义
来源:奇点糕 2023-09-08 13:35
中国国家癌症中心、中国医学科学院北京协和医学院肿瘤医院陈万青教授团队发表了一篇综述文章,全方位剖析了我国肝癌流行病学数据[1]。虽然「肝癌大国」属于老生常谈,但这篇综述中的两个数据还是非常发人警醒。
中国国家癌症中心、中国医学科学院北京协和医学院肿瘤医院陈万青教授团队发表了一篇综述文章,全方位剖析了我国肝癌流行病学数据[1]。虽然「肝癌大国」属于老生常谈,但这篇综述中的两个数据还是非常发人警醒。

首先,根据2012年到2015年间统计数据,我国约有55%的肝癌患者在确诊时已处于III期或IV期,而这一数据在美国和日本仅为15% 和5%,可见我国肝癌患者分期比例与西方的差异之大。也因晚期肝癌占比极高,同时生存预后差,导致我国整体肝癌5年生存率仅为14.1%,位列全球倒数第四(研究统计国家中)[1]。
第二个引人深思的数据是:我国男性肝癌发病率是女性的三倍,在男性患者中,45~59岁的中年人群占比超过35%,而这部分人群是生产的主力军,是多数中国家庭的经济支柱,正处于“上有老,下有小”的人生阶段。
晚期肝癌治疗迈入免疫联合时代,疗效提升是从未改变的治疗终极目标
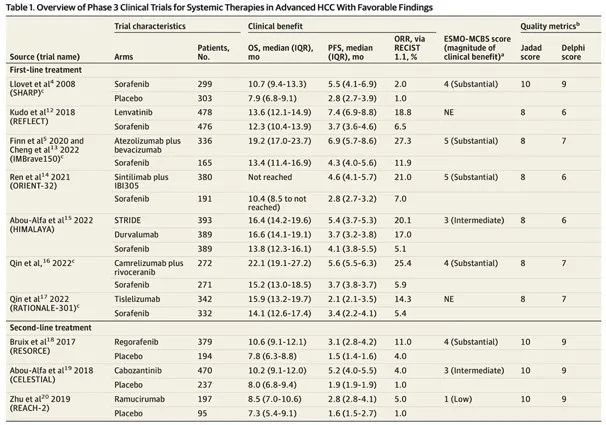
注:此处引用Camrelizumab plus rivoceranib (「双艾」组合)的数据出处为2022年ESMO口头报告。研究全文于2023年7月24日发表于《柳叶刀》主刊(https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(23)00961-3/fulltext)
我们看到,在抗血管生成药物治疗为主的时代,几项经典研究的中位生存期均徘徊在一年左右[2-3],虽然缓解了晚期肝癌治疗的燃眉之急,但是患者长期获益有限。随着免疫治疗的兴起,免疫治疗在晚期肝癌的尝试也急速铺开。
从CheckMate 040 、KEYNOTE-224等早期研究开始,免疫单药治疗在晚期肝癌显示出可观的抗癌活性[5]。随后卡瑞利珠单抗单药二线治疗晚期肝癌的研究显示:中位生存期可达14.9个月[6]。同时研究还发现,出现疾病进展的患者如继续使用卡瑞利珠单抗仍然能取得生存获益,部分患者中位生存期长达16.9个月。一系列免疫单药的探索性研究均提示,免疫治疗可让晚期肝癌患者生存获益,并具有拖尾效应。
而随后,免疫单药的探索前移到一线治疗,直面当时的标准治疗方案索拉非尼。RATIONALE 301[7]研究结果显示,替雷利珠单抗对比索拉非尼具有非劣效性,在生存期绝对值上与索拉非尼旗鼓相当。
免疫单药在晚期肝癌治疗的探索数据显示,中位生存期略有提升,但未带来本质的突破。生存期的延长仍是晚期肝癌面临的挑战,是临床未满足的治疗需求。与免疫单药不断尝试的同时,免疫联合治疗的探索就已铺开。
2020年,随着IMbrave150研究结果的公布,免疫联合治疗研究开启百花齐放的局面。 研究众多,但能给患者带来长期生存获益的研究却屈指可数。
先看免疫治疗联合大分子抗血管生成药物赛道,IMbrave150研究(阿替利珠单抗联合贝伐珠单抗)开辟了免疫+抗血管生成单抗类药物治疗晚期肝癌的纪元[8]。ORIENT-32研究(信迪利单抗联合贝伐珠单抗生物类似物(IBI305))[9],初报数据公布了OS的HR值,且具有统计学意义,进一步验证了免疫+抗血管生成单抗类药物治疗晚期肝癌的疗效。
但在初步数据论文发布两年后,ORIENT-32研究还未揭示其最终的OS数据,最近的 ASCO GI 2023 最新数据(Abstract 570,Abstract 530)也未公布OS数据。期待ORIENT-32可以尽快揭开神秘面纱,为免疫联合大分子抗血管生成药物治疗提供更多参考数据。
再看免疫联合小分子酪氨酸激酶抑制剂类抗血管生成药物的探索领域,COSMIC-312研究(阿替利珠单抗联合卡博替尼),以及LEAP-002研究(帕博利珠单抗联合仑伐替尼)先后折戟,OS未实现统计学差异[10~11]。这给免疫治疗联合抗血管生成小分子TKI的前景蒙上一层阴影。
但随着CARES-310研究(卡瑞利珠单抗+阿帕替尼)于2022年ESMO初次公布研究数据,PFS与OS双终点双阳性的结果,给免疫治疗联合抗血管生成小分子TKI的探索打了一剂强心针,让临床重新看到了希望。近期CARES-310研究数据全文于2023年7月24日发表在《柳叶刀》杂志的主刊[13],这是《柳叶刀》创刊200年来,肿瘤学领域中国学者主导的国际性III期临床研究首次问鼎其主刊,研究备受瞩目。

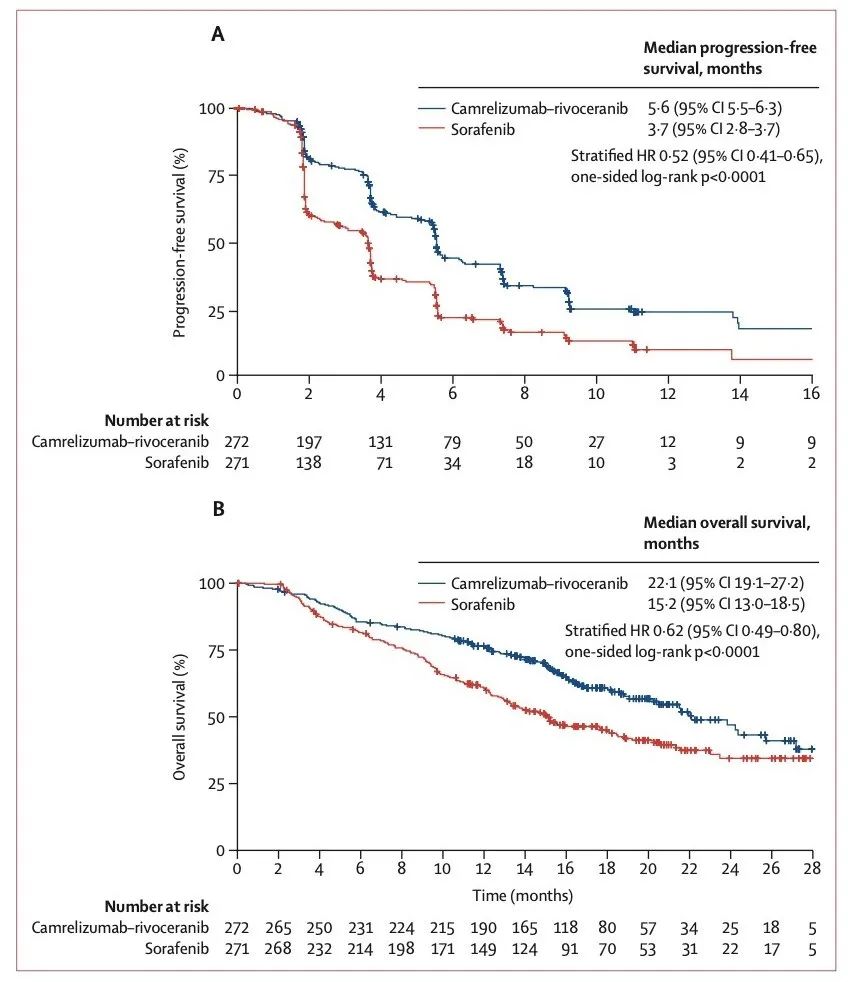
取得这样的成绩并非容易,要知道,在CARES-310研究中,入组的晚期患者中巴塞罗那分期C期(BCLC-C)比例高达86%,其中,74%患者有肉眼可见的大血管浸润和/或肝外转移。除此之外,入组患者体力状况评分(ECOG/PS)1分比例达56%,具有乙型肝炎病毒(HBV)感染背景者76%。就是说,CARES-310研究中患者的基线特征更复杂,更棘手,这给研究带来了非常大的挑战。
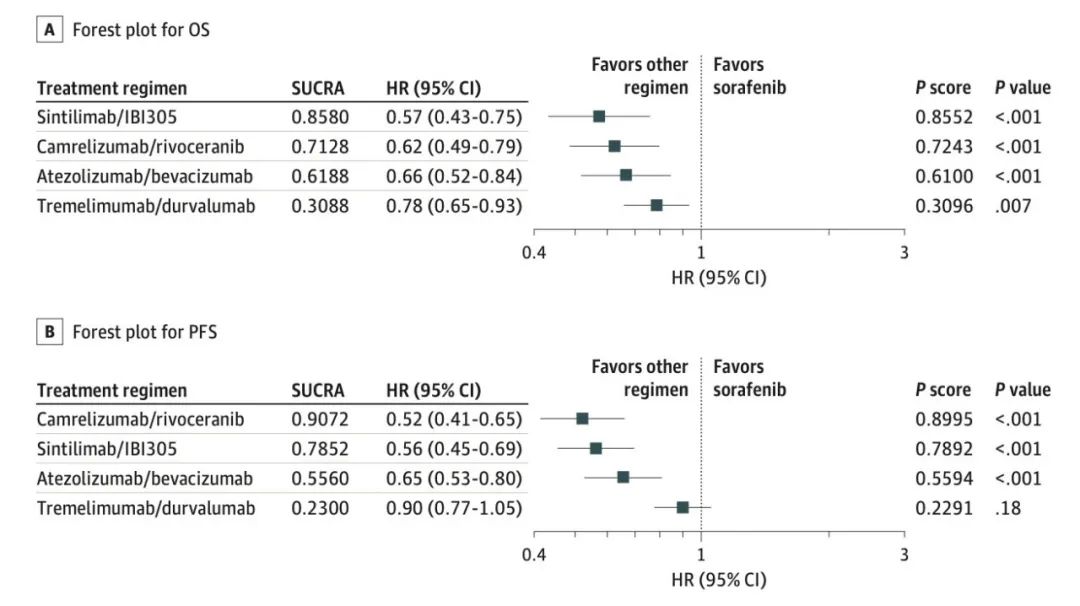
CARES-310研究以出色的疗效改变了免靶治疗的格局,T+A和「双艾」组合成为晚期肝癌免靶治疗的「双子星」。T+A治疗首创辉煌,OS达到19.2个月(HR 0.65; 95% CI 0.53-0.81; descriptive p< 0.001)。而「双艾」组合更是不负众望,将晚期肝癌OS逼近「两年」新纪元,OS达到了22.1个月 (HR 0.62 ;95% CI 0.49–0.80; one-sided p<0.0001) 。
免疫治疗牵手抗血管生成药物治疗,出血风险是否芒刺在背?
随着在全球范围内的获批上市,T+A方案也迅速写入了全球主要肝癌治疗指南,成为晚期肝癌一线优选方案[4]。2023年初,「双艾」组合在我国获得国家药监局(NMPA)的正式批准,用于晚期肝癌一线治疗。中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2022)将「双艾」组合推荐为晚期肝癌一线治疗优选方案[14]。
但需要注意的是,几大国际指南在推荐T+A治疗时,都明确指出,需要确认患者是否具有高消化道出血风险。由于目前「双艾」组合和「达达」组合未在国外获批适应证,如果患者存在高消化道出血风险,则只能推荐使用度伐利尤单抗联合tremelimumab双免治疗。
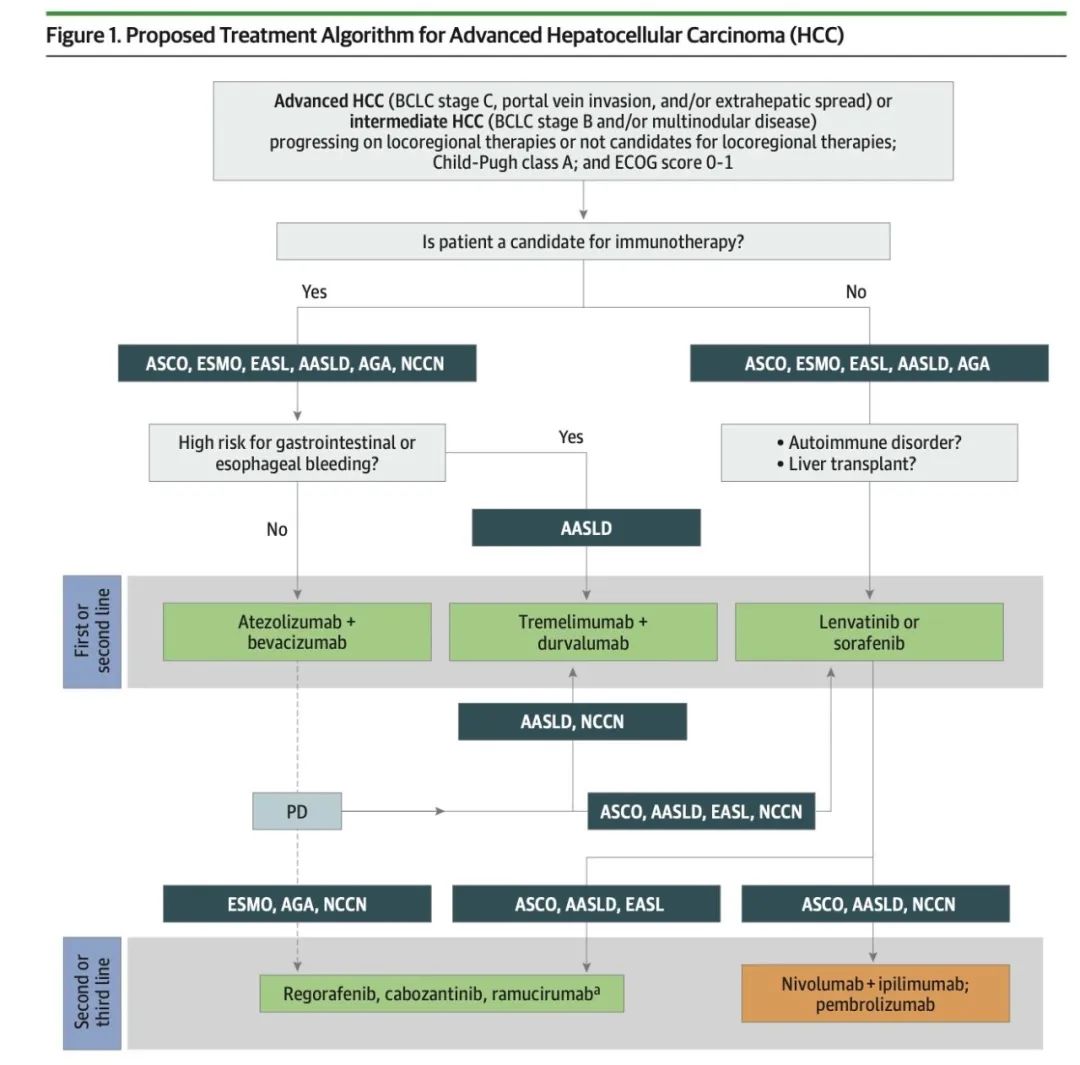
在IMbrave150研究中,为了避免贝伐珠单抗引发出血的潜在风险,研究排除了未治疗或治疗不完全的食管或胃静脉曲张,有出血或高出血风险的患者。入组患者必须接受上消化道内镜检查(EGD),并对所有大小的静脉曲张进行评估和治疗,按照当地的治疗标准,在入组之前完成治疗。
最终结果显示,T+A组有25.2%的患者发生了贝伐珠单抗引起的任何级别的出血事件,而索拉非尼组这一比例为17.3%。两组分别有6.4%和5.7%的患者经历了3~4级出血。除此之外,T+A组有5名患者(1.5%)出现了5级出血/急性出血事件[15]。
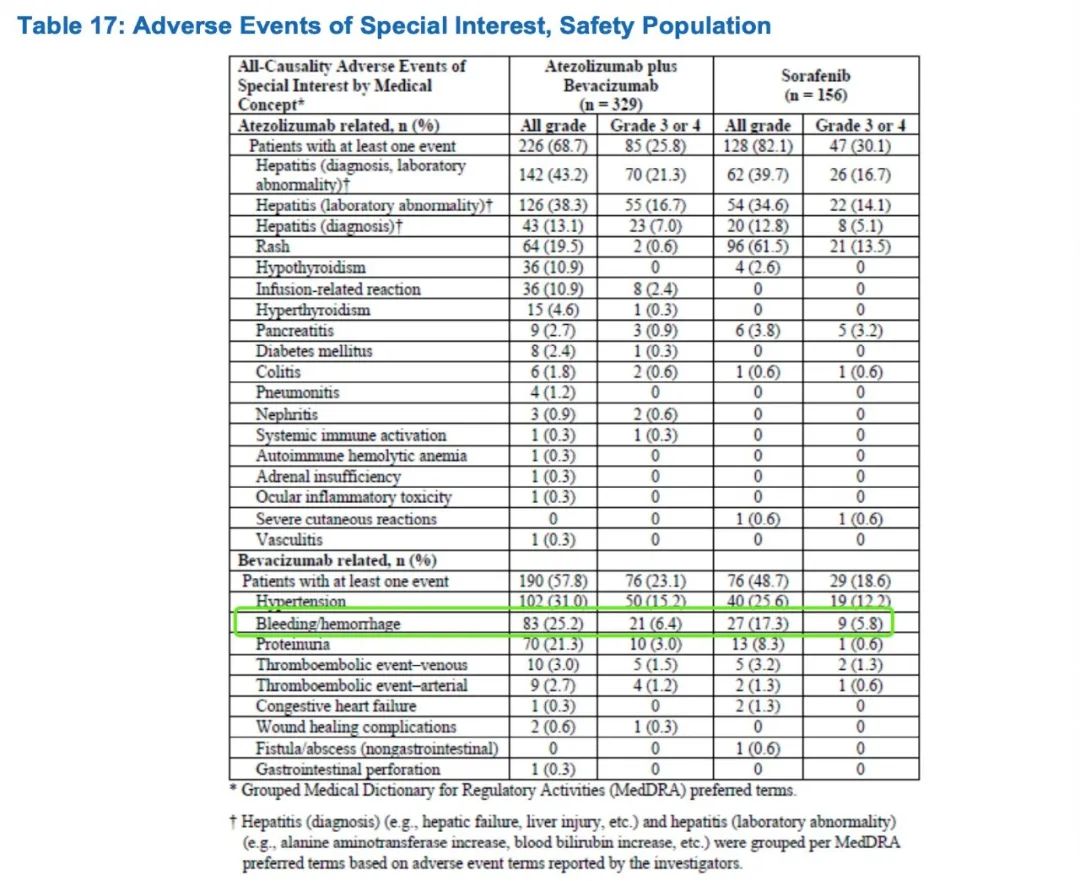
今年ASCO大会上一项真实世界、多中心、回顾性研究,纳入112例接受阿替利珠单抗+贝伐珠单抗治疗的肝癌患者,旨在确定真实世界患者的EGD应用情况、静脉曲张比例、治疗后出血情况[17]。
研究发现,共有78例(69%)患者在治疗开始前6个月内进行了EGD,在完成消化道内镜检查的患者中,有32例(41%)存在静脉曲张, 15例(20%)患者需用套扎或β受体阻滞剂 。接受T+A治疗的患者中,有17例(15%)患者发生出血事件,EGD人群、未EGD人群分别为18%和9% ;有6例(5%)患者发生消化道出血事件,EGD人群、未EGD人群分别为6%和3% 。
也是基于大量的临床研究证据,我国《肝细胞癌分子靶向药物临床应用中国专家共识(2022版)》也推荐[18],T+A治疗前建议伴有高出血风险的食管胃底静脉曲张的患者评估食管胃底静脉曲张情况并进行预处理。
那么,严重的出血事件是否是靶免联合治疗绕不过去的坎呢?情况并非如此。在CARES-310研究中,研究入选前没有对上消化道内镜检查的强制要求,在这种情况下,仍然没有出现3级以上的出血。这意味患者在治疗前可能无需开展消化道出血风险的筛查。
能证明临床获益仅仅是第一步,惠及更多患者,才是真正的好药
在高额的支出背后,我们还需要看到,中国肝癌患者的地区和年龄分布特点,农村发病率高于城市发病率,壮年男性占比超过35%,这意味着大量农村中壮年患者及家庭需要面对非常沉重的经济负担。
面对这样的患者群体,好药要真正落地,真正惠及更多中国患者,一定需要提高可及性。可喜的是,近年来,我国在肿瘤创新药的审批上已经和国际接轨,同时随着大量国内创新药的获批上市,我国肝癌患者创新药物的一线治疗选择甚至超过了西方国家。
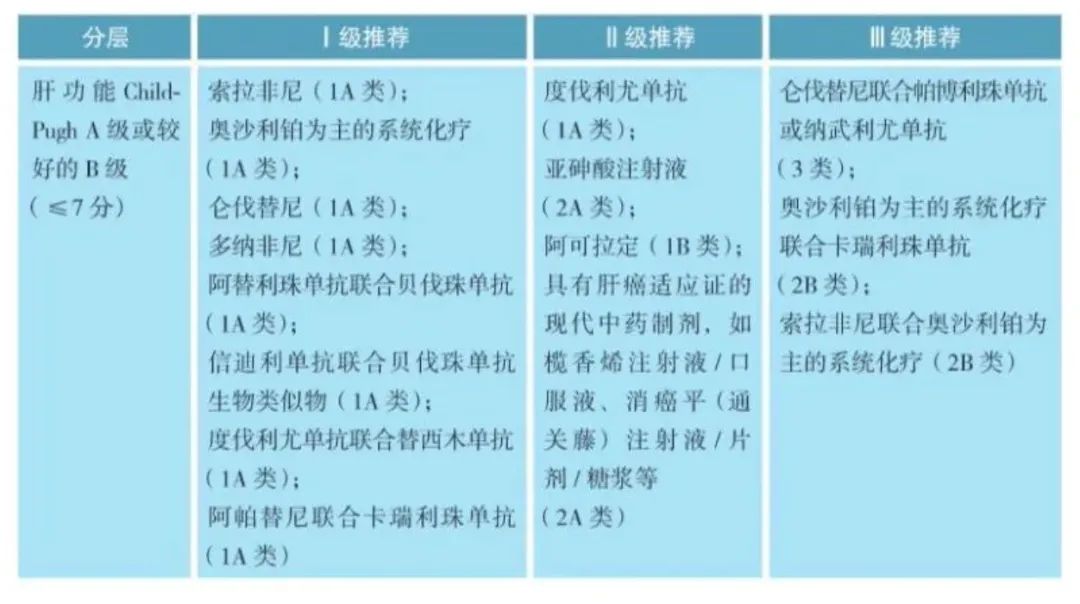

在提供更多疗效优异的治疗选择基础上,国产创新药也为国内患者提供了更具可及性的价格,让更多患者能够真正用上好药。免疫联合治疗的突飞猛进让晚期肝癌患者生存期有望超越两年大关,而让中国几十万肝癌患者都能用得起疗效更佳的治疗方案,是不可逃避的命题。目前「达达」组合已经纳入医保,未来「双艾」组合若纳入医保,国内患者的治疗选择和可及性会进一步提高。
参考文献:
【1】 Li Q, Cao M, Lei L, Yang F, Li H, Yan X, He S, Zhang S, Teng Y, Xia C, Chen W. Burden of liver cancer: From epidemiology to prevention. Chin J Cancer Res. 2022 Dec 30;34(6):554-566.
【2】 Llovet JM, Ricci S, Mazzaferro V, et al; SHARP Investigators Study Group. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med. 2008;359 (4):378-390.
【3】 KudoM,FinnRS,QinS,etal.Lenvatinibversus sorafenib in first-line treatment of patients with unresectable hepatocellular carcinoma:
a randomised phase 3 non-inferiority trial. Lancet. 2018;391(10126):1163-1173.
【4】 Cappuyns, S., Corbett, V., Yarchoan, M., Finn, R. S., & Llovet, J. M. (2023). Critical Appraisal of Guideline Recommendations on Systemic Therapies for Advanced Hepatocellular Carcinoma: A Review. JAMA oncology.
【5】 Zhu AX, Finn RS, Edeline J, Cattan S, Ogasawara S, Palmer D, Verslype C, Zagonel V, Fartoux L, Vogel A, Sarker D, Verset G, Chan SL, Knox J, Daniele B, Webber AL, Ebbinghaus SW, Ma J, Siegel AB, Cheng AL, Kudo M; KEYNOTE-224 investigators. Pembrolizumab in patients with advanced hepatocellular carcinoma previously treated with sorafenib (KEYNOTE-224): a non-randomised, open-label phase 2 trial. Lancet Oncol. 2018 Jul;19(7):940-952.
【6】 Qin S, Ren Z, Meng Z, Chen Z, Chai X, Xiong J, Bai Y, Yang L, Zhu H, Fang W, Lin X, Chen X, Li E, Wang L, Chen C, Zou J. Camrelizumab in patients with previously treated advanced hepatocellular carcinoma: a multicentre, open-label, parallel-group, randomised, phase 2 trial. Lancet Oncol. 2020 Apr;21(4):571-580.
【7】 Tislelizumab versus sorafenib in first-line treatment of unresectable hepatocellular carcinoma: Impact on health-related quality of life in RATIONALE-301 population.
Richard S. Finn, Shukui Qin, Masatoshi Kudo, Tim Meyer, Frederic Boisserie, Songzi Li, Yaxi Chen, Gisoo Barnes, Ramil Abdrashitov, Andrew X. Zhu, and Arndt Vogel Journal of Clinical Oncology 2023 41:4_suppl, 495-495
【8】 Finn, R. S., Qin, S., Ikeda, M., Galle, P. R., Ducreux, M., Kim, T. Y., ... & Cheng, A. L. (2020). Atezolizumab plus bevacizumab in unresectable hepatocellular carcinoma. New England Journal of Medicine, 382(20), 1894-1905.
【9】 Ren, Z., Xu, J., Bai, Y., Xu, A., Cang, S., Du, C., ... & Fan, J. (2021). Sintilimab plus a bevacizumab biosimilar (IBI305) versus sorafenib in unresectable hepatocellular carcinoma (ORIENT-32): a randomised, open-label, phase 2–3 study. The Lancet Oncology, 22(7), 977-990.
【10】 Kelley, R. K., Rimassa, L., Cheng, A. L., Kaseb, A., Qin, S., Zhu, A. X., ... & Yau, T. (2022). Cabozantinib plus atezolizumab versus sorafenib for advanced hepatocellular carcinoma (COSMIC-312): a multicentre, open-label, randomised, phase 3 trial. The Lancet Oncology, 23(8), 995-1008.
【11】 Finn, R. S., Kudo, M., Merle, P., Meyer, T., Qin, S., Ikeda, M., ... & Llovet, J. (2022). LBA34 Primary results from the phase III LEAP-002 study: Lenvatinib plus pembrolizumab versus lenvatinib as first-line (1L) therapy for advanced hepatocellular carcinoma (aHCC). Annals of Oncology, 33, S1401.
【12】 Abou-Alfa, G. K., Lau, G., Kudo, M., Chan, S. L., Kelley, R. K., Furuse, J., ... & Sangro, B. (2022). Tremelimumab plus durvalumab in unresectable hepatocellular carcinoma. NEJM Evidence, 1(8), EVIDoa2100070.
【13】 Qin, S., Chan, S. L., Gu, S., Bai, Y., Ren, Z., Lin, X., ... & Verset, G. (2023). Camrelizumab plus rivoceranib versus sorafenib as first-line therapy for unresectable hepatocellular carcinoma (CARES-310): a randomised, open-label, international phase 3 study. The Lancet.
【14】 中国临床肿瘤学会(CSCO)原发性肝癌诊疗指南(2022)
【15】 CADTH PCODR FINAL CLINICAL GUIDANCE REPORT:Clinical Report,ATEZOLIZUMAB (TECENTRIQ) (Hoffman La-Roche Limited),Indication: In combination with bevacizumab, for the first-line treatment of adult patients with unresectable or metastatic hepatocellular carcinoma who require systemic therapy.
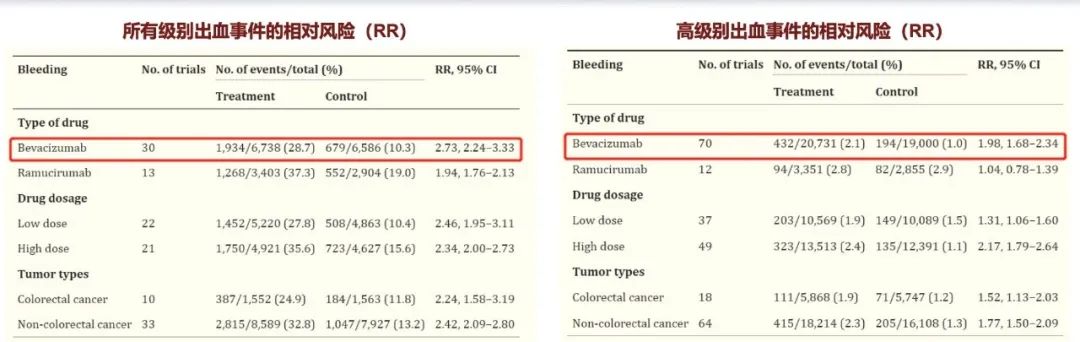
【16】 Xiao B, Wang W, Zhang D. Risk of bleeding associated with antiangiogenic monoclonal antibodies bevacizumab and ramucirumab: a meta-analysis of 85 randomized controlled trials. Onco Targets Ther. 2018 Aug 21;11:5059-5074.
【17】 Lee CL, et al. 2023 ASCO. Abs 4105.
【18】 中国医师协会肝癌专业委员会. 肝细胞癌分子靶向药物临床应用中国专家共识(2022版) [J] . 中华医学杂志, 2022, 102(34) : 2655-2668. DOI: 10.3760/cma.cn112137-20220623-01387.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


