《自然评论·胃肠病学&肝病学》重磅综述:一文读懂晚期肝癌治疗范式的发展方向!
来源:奇点糕 2023-01-09 16:31
Nature Reviews Gastroenterology & Hepatology杂志发表了一篇综述文章[6],总结了晚期HCC全身治疗的最新进展,讨论了未满足的需求和未来的发展方向。
肝癌目前仍然是最常见和最致命的恶性肿瘤之一,据世卫组织估计,到2030年,肝癌将导致超100万的死亡[1]。
肝细胞癌(HCC)是肝癌的主要组织学类型,约占肝癌总病例数量的90%[2]。HCC的主要诱因是乙型或丙型肝炎病毒(HBV或HCV)感染,约占HCC数量的一半[3],非酒精性脂肪性肝病(NAFLD)和酗酒也是HCC的常见诱因[2]。
HCC的治疗因临床分期而异,全部或部分肝切除术是早期患者的主要治疗方法,中期患者则可以接受局部治疗,例如经动脉化疗栓塞术,而晚期患者,全身治疗是唯一能够带来生存获益的治疗选择[4]。由于早期症状不明显,有超过50%的患者诊断时即为晚期[5]。
过去,化疗是晚期HCC患者全身治疗的主要方法,而2007年,酪氨酸激酶抑制剂(TKI)索拉非尼的获批开启了HCC治疗的新时代,时至今日,靶向药物层出不穷,“当红炸子鸡”免疫治疗也取得了有希望的进展,显著扩大了HCC治疗的备选清单。
近日,Nature Reviews Gastroenterology & Hepatology杂志发表了一篇综述文章[6],总结了晚期HCC全身治疗的最新进展,讨论了未满足的需求和未来的发展方向。

晚期HCC治疗现状
继索拉非尼后,仑伐替尼的上市巩固了多激酶抑制剂在晚期HCC一线治疗中的地位,但这两种药物的生存获益都不是很强势。近年来,PD-L1抑制剂阿替利珠单抗和VEGF抑制剂贝伐珠单抗联合治疗成为了又一个重要里程碑,IMbrave150试验显示,在不可切除的HCC患者中,联合治疗达到了29.8%的总缓解率(ORR),相比索拉非尼有5.8个月的生存获益。
值得注意的是,过去十年中,与索拉非尼相比,这是第一个显示出统计学上显著改善总生存率的治疗方法,也代表了免疫检查点抑制剂首次用于HCC的一线治疗。对IMbrave150试验结果的进一步分析揭示了一些患者特征,包括效应T细胞特征和瘤内CD8 T细胞密度,可作为预测患者临床获益的生物标志物。
一线治疗的范式转变使得临床专家们也开始重新考虑二线治疗方案,目前已批准的二线治疗方案,包括瑞戈非尼、卡博替尼、雷莫芦单抗、帕博利珠单抗,以及纳武利尤单抗和伊匹木单抗联合治疗,仅在既往索拉非尼治疗的患者中进行评估。
一些专家认为,已批准的靶向药物(索拉非尼、仑伐替尼、瑞戈非尼、卡博替尼或雷莫芦单抗)在二线治疗上是等同的,但也有专家认为索拉非尼和仑伐替尼应优先应用于二线,其余三种应作为三线及以上的治疗方案。
免疫治疗对于传统一线治疗后疾病进展的患者具有治疗潜力,尤其是合并严重肝硬化或心血管疾病且不能耐受其他TKI的。在KEYNOTE-224试验中,帕博利珠单抗显示出18.3%的ORR,然而,KEYNOTE-240试验显示,与安慰剂组相比,帕博利珠单抗组死亡风险仅降低22%,总生存期增加3.3个月。
值得注意的是,免疫治疗的获益可能因病因而异,病毒性HCC患者相比其他HCC患者获益更多,KEYNOTE-240试验中的亚洲亚组(病毒性HCC的比例为67.5%,高于总人群的39.9%)死亡风险下降45%,总生存期增加5.5个月。
纳武利尤单抗和伊匹木单抗联合治疗是第一个被批准用于一线治疗失败后的晚期HCC患者双免联合方案,与更高的缓解率有关,但是否能够转化为总生存期的改善仍有待确定。
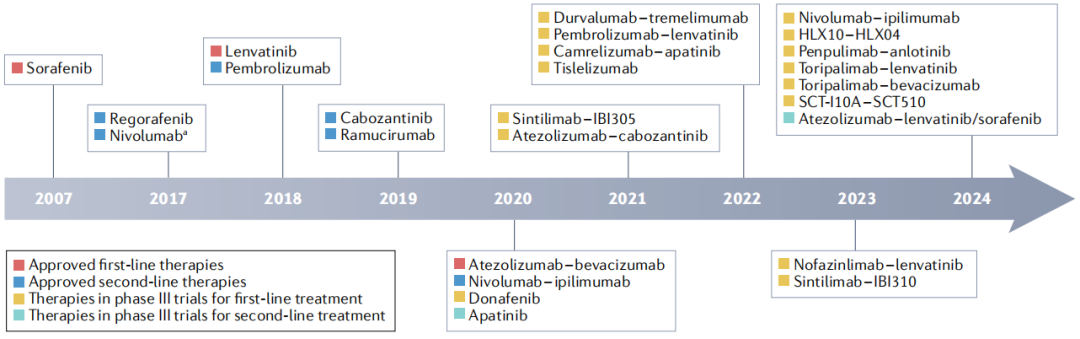
晚期HCC全身治疗的发展
新兴的单一疗法
靶向治疗是目前晚期HCC的主要治疗方法,新兴的靶向治疗可分为两类:作用机制与以前相似的新多激酶抑制剂,和靶向特定靶点的小分子药物。前者的代表是多纳非尼,与索拉非尼类似,但半衰期延长、药物清除率降低,在中国的III期临床试验中,与索拉非尼相比,多纳非尼表现出总生存期的显著改善(HR=0.83,p=0.0245)。
类似的还有对VEGFR2具有高选择性的阿帕替尼,也在中国晚期HCC患者中表现出总生存期的获益(对照组为安慰剂,HR=0.79,p=0.048)。
靶向特定靶点的小分子药物主要包括选择性MET和FGFR4抑制剂、TGF-β抑制剂和PI3K-AKT-mTOR抑制剂。
MET是肝细胞生长因子(HGF)的酪氨酸激酶受体,在约50%的HCC患者中异常,HGF-MET表达升高与较差的生存结局有关。6种MET抑制剂(4种非选择性和2种选择性抑制剂)进入了临床试验阶段,其中选择性抑制剂(特泊替尼和卡马替尼)对MET高的HCC患者效果更好、毒性更低,是临床研究的重点。
选择性FGFR4抑制剂fisogatinib(BLU-554)在I期临床试验的FGF19阳性组(FGF19是FGFR4的内源性配体)表现出17%的ORR,而FGF19阴性组为0。TGF-β在癌变后期阶段可作为肿瘤启动子,促进癌细胞的侵袭和转移,二线治疗临床试验中,TGFβR1抑制剂galunisertib在高水平和低水平AFP患者中分别达到7.3和16.8个月的中位总生存期。
PI3K-AKT-mTOR是HCC的另一个关键信号通路,目前,一些mTOR抑制剂(依维莫司和temsirolimus)作为单一疗法在临床试验中已经宣告失败,而新mTOR抑制剂,例如onatasertib正在晚期HCC的早期临床试验中进行验证。
肝脏中含有多种免疫细胞,并表达和分泌抑制因子以维持抗炎环境,因此,HCC患者也是免疫治疗的理想候选者。单一的免疫治疗也可分为两类:针对成熟靶点(PD-1/PD-L1和CTLA-4),以及其他免疫调节分子的免疫治疗药物。
PD-1/PD-L1或CTLA-4抑制剂仍是免疫治疗临床试验的主流,除了纳武利尤单抗和帕博利珠单抗外,其他可用于HCC单药治疗的还有卡瑞利珠单抗和替雷利珠单抗(PD-1抑制剂),以及avelumab、度伐利尤单抗和阿替利珠单抗(PD-L1抑制剂)。I/II期临床试验的结果显示,在二线中,卡瑞利珠单抗和替雷利珠单抗与纳武利尤单抗和帕博利珠单抗临床获益相近。
其他免疫调节分子主要包括TIM3、LAG3、TIGIT和IDO1,以及共刺激分子(例如CD40、CD134和ICOS)。
新兴的联合疗法
广泛的临床数据表明,单一疗法通常与耐药性的发展有关,只能提供有限的临床获益,相比之下,联合更有可能克服耐药性,具有更大的获益。目前,HCC的联合治疗方案很少,存在相当大的机遇与挑战。
联合疗法的选择包括靶向联合治疗、免疫联合治疗、免疫联合抗VEGF/VEGFR治疗、免疫联合多激酶抑制剂治疗,及免疫联合其他治疗。
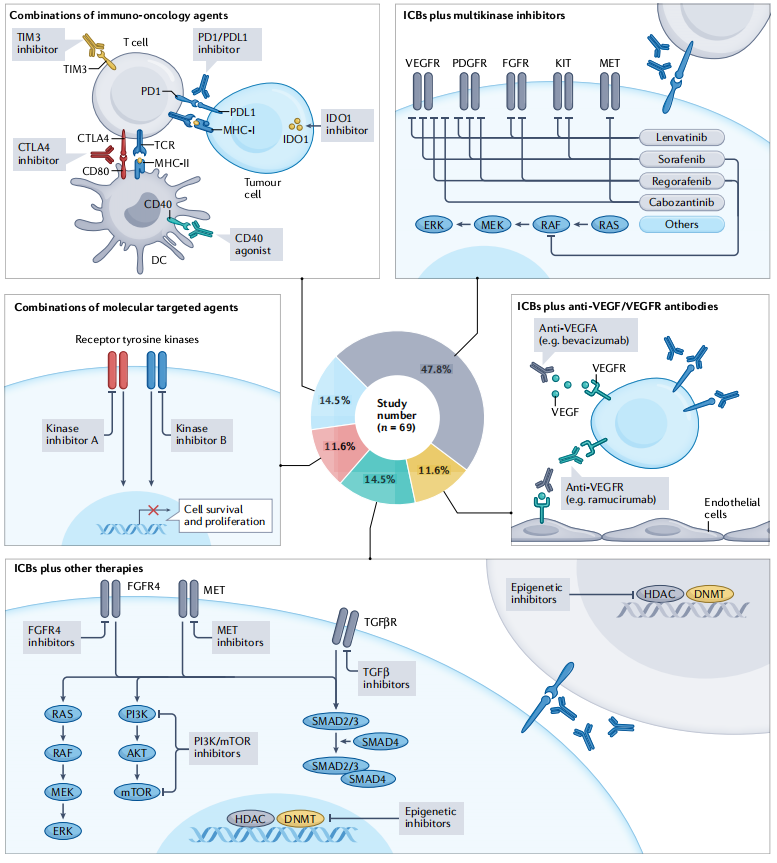
HCC的新兴联合治疗类型
未满足的需求和未来发展方向
作者提出,第一,需要寻找合适的生物标志物。目前,在晚期HCC患者中,全身治疗的有效性表现出高度异质性,因此,需要预测治疗响应的生物标志物,例如PI3K-AKT-mTOR通路相关突变的患者使用索拉非尼治疗通常具有较低的ORR和较短的中位总生存期/无进展生存期。
对于免疫治疗,候选生物标志物可以分为四类:免疫组化标志物、基因组标志物、转录组标志物和其他。先前研究发现,HCC免疫组化标志物中,PD-1、PD-L1、CD3和CD8具有一定的生存获益预测能力,但预测结果并不稳健。基因组标志物的代表是肿瘤突变负荷(TMB),但一些研究显示,HCC的免疫治疗响应与TMB没有相关性,还需要更多的研究来验证。
第二,针对“不可成药”靶点的探索需要继续。HCC中的显性驱动突变,包括TERT启动子(TERTp)、CTNNB1和TP53,仍然是“不可成药”靶点。
TERTp是HCC中最常见的突变基因,与HCC的发生密切相关,约60%的HCC患者携带这一突变,CTNNB1突变则与重要的致癌信号通路WNT-β连环蛋白的激活有关,发生率约为50%,至于TP53,它的突变会导致肿瘤抑制因子p53功能丧失,大多数靶向药物的作用机制都是抑制过度活跃的癌基因,而不是恢复失活的抑制因子,这也是TP53靶点难以成药的原因所在。
第三,需要探索新的靶向治疗策略。
过去几年,已经出现了一些创新的靶向治疗策略,例如序贯联合治疗,先手药物削弱癌细胞,使其对后手药物更加敏感,与同时给药的传统方式相比,毒性通常也更低。这个概念的一个成功应用是“one-two punch”疗法,利用衰老诱导因子CDC7处理TP53突变的HCC细胞,随后使用mTOR抑制剂,选择性地清除了衰老的HCC细胞。
除此之外,靶向治疗导致旁路激活产生耐药性,可以通过与旁路靶点抑制剂联合治疗,以避免耐药的发生,还有合成致死、交替治疗等策略也在探索中。
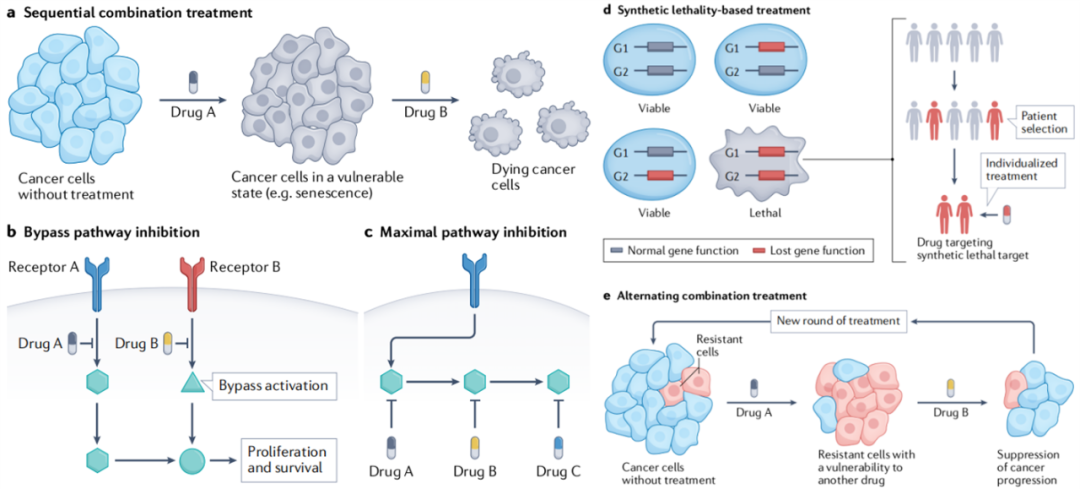
最后,与新靶向治疗策略相对应,需要扩展新的免疫治疗。
除免疫检查点抑制剂外,过继细胞疗法(ACT)是目前最具代表性的新兴免疫治疗,已经尝试过的ACT包括输注淋巴因子激活的杀伤细胞、细胞因子诱导的杀伤细胞和肿瘤浸润淋巴细胞。CAR-T和TCR-工程化T细胞也在HCC中表现出了治疗潜力,是ACT发展的重点。TCR-工程化T细胞相比CAR-T似乎更适合实体瘤,但更容易出现脱靶诱导的毒性。
其余新兴免疫治疗还包括肿瘤疫苗、溶瘤病毒和双特异性抗体。需要注意的是,越来越多的研究发现,肠道微生物与免疫治疗的疗效有密切联系,肠道微生物可以通过胆道和肝门静脉参与调节肝脏微环境,在接受PD-1抑制剂治疗的HCC患者中进行的研究显示,治疗响应和无响应者之间的肠道微生物组成具有显著差异,因此,在免疫治疗的试验中,需要结合肠道微生物,以改善免疫治疗效果。
参考文献:
[1] Villanueva A. Hepatocellular carcinoma[J]. New England Journal of Medicine, 2019, 380: 1450-1462.
[2] Llovet, J.M., Kelley, R.K., Villanueva, A. et al. Hepatocellular carcinoma[J]. Nature Reviews Disease Primers, 2021, 7: 6.
[3] Akinyemiju T, Abera S, Ahmed M, et al. The burden of primary liver cancer and underlying etiologies from 1990 to 2015 at the global, regional, and national level: results from the global burden of disease study 2015[J]. JAMA oncology, 2017, 3(12): 1683-1691.
[4] Reig M, Forner A, Rimola J, et al. BCLC strategy for prognosis prediction and treatment recommendation: The 2022 update[J]. Journal of hepatology, 2021.
[5] Park J W, Chen M, Colombo M, et al. Global patterns of hepatocellular carcinoma management from diagnosis to death: the BRIDGE Study[J]. Liver International, 2015, 35(9): 2155-2166.
[6] Yang C, Zhang H, Zhang L, et al. Evolving therapeutic landscape of advanced hepatocellular carcinoma[J]. Nature Reviews Gastroenterology & Hepatology, 2022: 1-20.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


