科研人员发现内质网塑形蛋白ATL2/3调控自噬起始位点的形成
来源:生物物理所 2021-05-19 12:08
Journal of Cell Biology在线发表了中国科学院生物物理研究所研究员张宏课题组题为Atlastin 2/3 regulate ER targeting of the ULK1 complex to initiate autophagy的研究论文。该研究揭示了ATL2/3和参与自噬起始的ULK1复合体直接相
Journal of Cell Biology在线发表了中国科学院生物物理研究所研究员张宏课题组题为Atlastin 2/3 regulate ER targeting of the ULK1 complex to initiate autophagy的研究论文。该研究揭示了ATL2/3和参与自噬起始的ULK1复合体直接相互作用,促进其在内质网上组装,从而介导自噬体的形成。
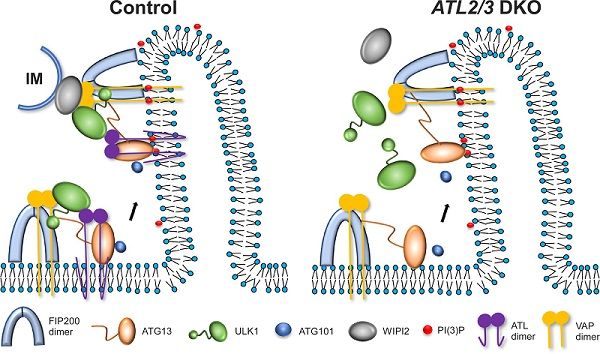
自噬(autophagy)是真核细胞中由溶酶体介导的降解途径。自噬通过形成双层膜的自噬体以包裹部分的细胞质组分,如受损的细胞器、错误折叠的蛋白等物质,并将其运送到溶酶体进行降解。内质网在多细胞生物的自噬过程中发挥重要功能:当细胞感受到应激刺激等自噬诱导信号时,ULK1复合体首先被招募到内质网上,形成自噬起始位点,进而招募下游的自噬蛋白共同诱导隔离膜的形成;在隔离膜的延伸过程中,ULK1复合体与WIPI2蛋白相互作用,介导隔离膜与内质网的膜接触的形成,为自噬体的形成提供脂来源。哺乳动物细胞中,ULK1复合体主要包括FIP200、ULK1、ATG13和ATG101蛋白,这四个蛋白相互作用,动态地结合在一起。目前,学界尚不清楚ULK1复合体在内质网上动态组装的机制。
内质网塑形蛋白Atlastin是一类dynamin超家族蛋白,该家族由ATL1、ATL2和ATL3组成,负责调控内质网的融合,ATLs的缺失会造成内质网形态的改变。研究人员发现,敲除ATL2/3会抑制自噬活性。自噬诱导后,细胞质中弥散分布的LC3I经过脂化作用,以LC3II的形式偶联到自噬体膜上。研究显示,在ATL2/3双敲细胞中,LC3II/LC3I比例明显降低,脂化过程减慢。同时,自噬底物p62明显累积,自噬体数量减少,表明敲除ATL2/3抑制自噬的活性。随后研究发现,与对照细胞相比,在ATL2/3双敲细胞中,FIP200和ATG13的内质网招募没有明显改变,但ULK1与ATG101的招募显着减少。ATG13-ULK1及ATG13-ATG101之间的相互作用也明显减弱。进一步研究表明,ATL2/3帮助ATG13招募ULK1与ATG101。此外,研究还发现,在ATL2/3双敲细胞中,WIPI2和ULK1及FIP200之间的相互作用减弱,电镜结果表明,自噬体/隔离膜与内质网膜接触也减少,说明敲除ATL2/3抑制内质网与隔离膜接触的形成。(生物谷Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


