Nature子刊:宫宁强等人开发小分子调控的双抗,保留抗肿瘤活性的同时避免毒性作用
来源:生物世界 2024-03-01 09:46
研究结果表明,SiTE可以诱导有效的抗肿瘤活性,且不会产生严重的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性。
宾夕法尼亚大学 Michael Mitchell 团队(宫宁强博士为第一作者),在 Nature Biomedical Engineering 期刊发表了题为:Small-molecule-mediated control of the anti-tumour activity and off-tumour toxicity of a supramolecular bispecific T cell engager 的研究论文。
该研究开发了一种可切换的双特异性T细胞纳米接合器(SiTE),基于该方法开发的CD3×HER2双特异性抗体诱导了强烈的肿瘤特异性适应性免疫反应,防止了肿瘤复发。更重要的是,使用已获FDA批准的小分子药物金刚烷胺(AMD)分解超分子聚集体,使T细胞与肿瘤细胞分开,停止CD3×HER2产生的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性。


Michael Mitchell教授和第一作者宫宁强博士(图片源自Mitchell实验室主页https://mitchell-lab.seas.upenn.edu/lab-members/)
研究表明,超分子化学可以将蛋白质组装成一维、二维或三维结构,并通过小分子控制其分解。受此启发,研究团队提出了一种可切换的双特异性T细胞纳米接合器(SiTE)用于可控的癌症免疫治疗。
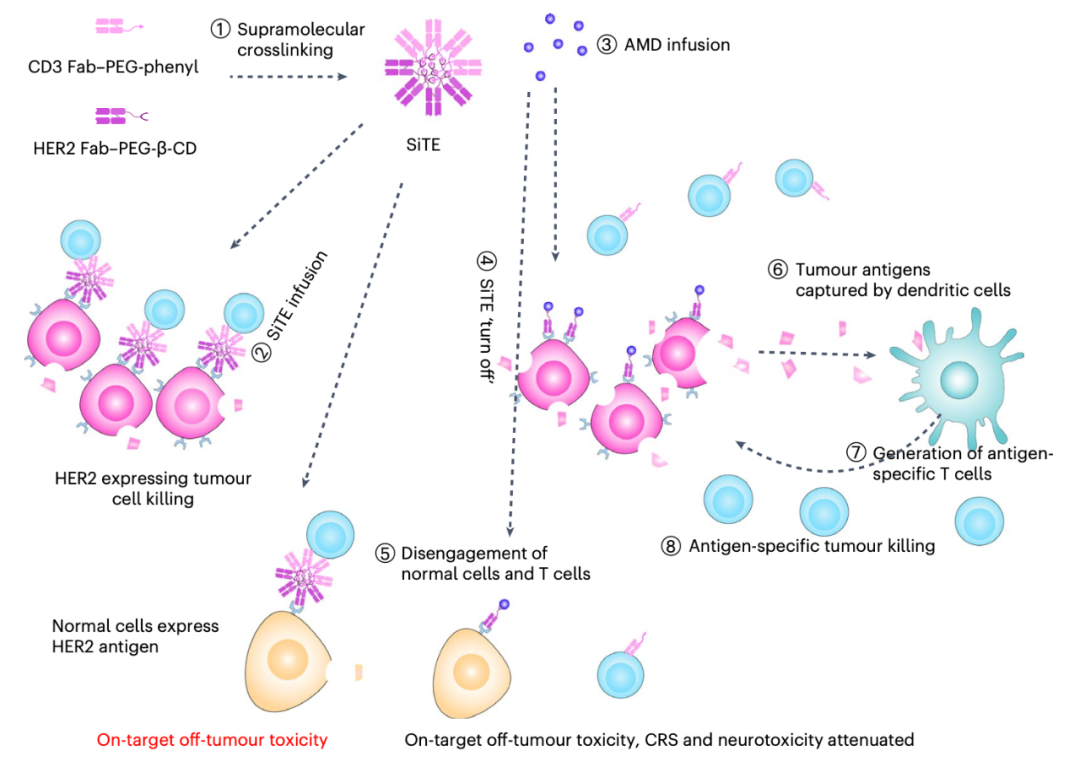
用于癌症免疫治疗的SiTE
与传统双特异性T细胞接合器(BiTE)类似,SiTE可以结合T细胞和肿瘤细胞,有效诱导肿瘤细胞毒性,但与传统BiTE不同的是,SiTE具有按需切换治疗的能力。传统BiTE引起的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性难以控制。而SiTE可以通过注射小分子金刚烷胺(AMD)进行分解,从而在注射后立即停止可能出现的毒性作用。

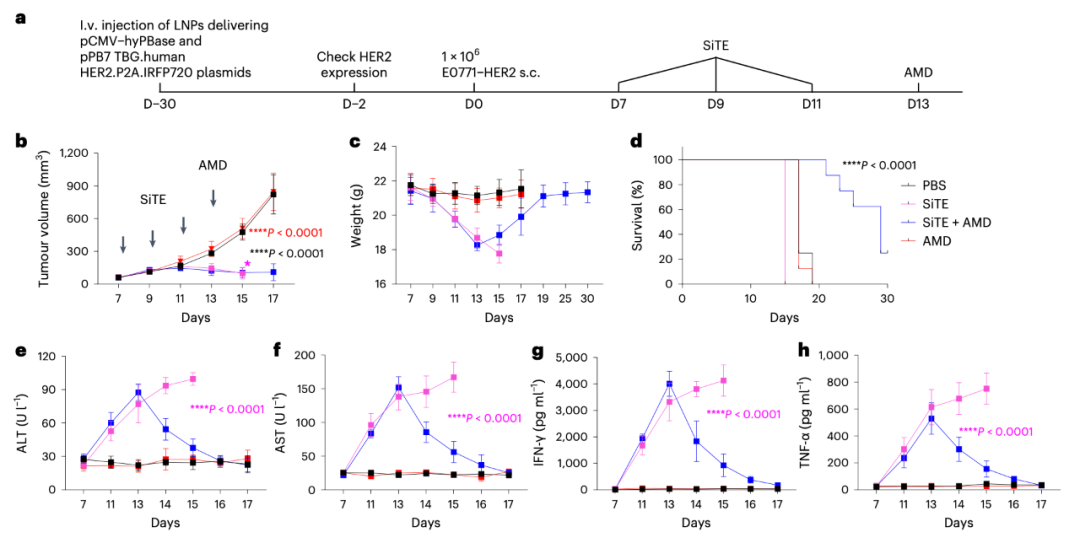
AMD降低SiTE在体内的肿瘤非靶向毒性
金刚烷胺(AMD)于1976年首次被美国FDA批准作为甲流的预防药物,随后被批准用于治疗帕金森病。因此,AMD是调控SiTE的理想候选者,因为其药代动力学特性和安全性已经在临床中得到了证实。研究团队评估了AMD响应性SiTE在体外和体内动物模型中的肿瘤细胞裂解能力,并证明了SiTE活性在体内的可控性。
此外,该研究开发了一种在健康肝脏组织中稳定表达人类HER2的小鼠模型,并研究了SiTE引起的非肿瘤毒性。该研究还比较了低剂量和高剂量下SiTE的治疗效果和抗肿瘤活性。并利用人源化免疫系统小鼠模型比较了SiTE和BiTE(blinatumomab)的抗肿瘤效果、肿瘤非靶向毒性、细胞因子释放综合征和神经毒性。
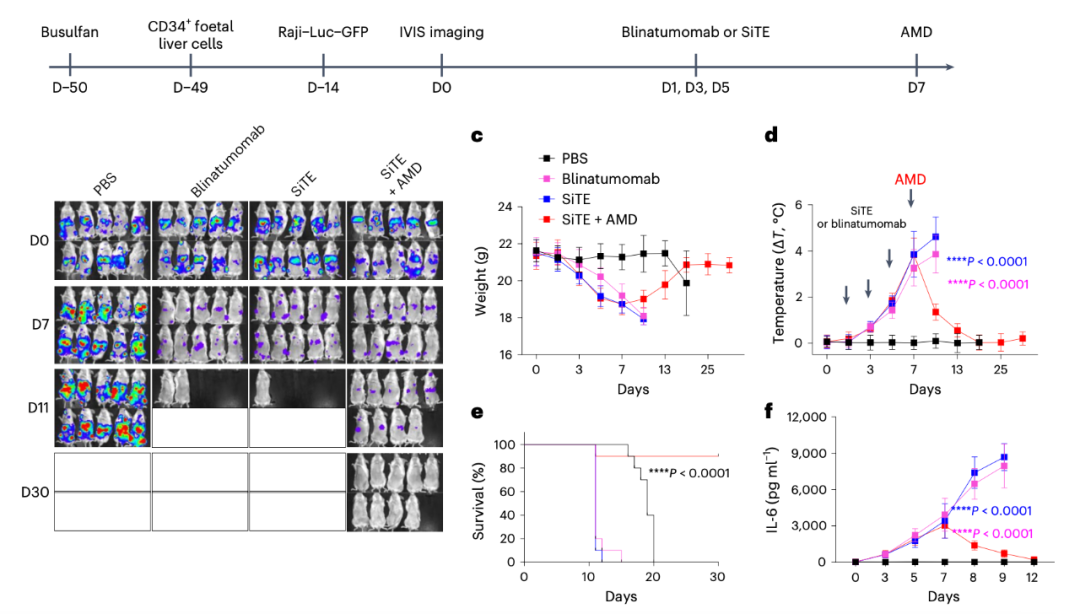
AMD降低SiTE在体内诱导细胞因子释放综合征(CRS)
总的来说,研究结果表明,SiTE可以诱导有效的抗肿瘤活性,且不会产生严重的肿瘤非靶向毒性、细胞因子释放综合征和神经毒性,这可能作为未来设计癌症免疫治疗的双特异性抗体的广泛适用策略,以避免非肿瘤毒性的产生。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


