《细胞·代谢》:科学家首次发现,限时进食可恢复昼夜节律,改善阿尔茨海默病的病理变化和记忆力
来源:奇点糕 2023-09-05 09:30
Desplats团队的这一研究成果首次表明,通过限时进食调节AD模式小鼠的昼夜节律,可以改变诱发AD的关键通路,进而改善模式动物的认知。
我们都知道,睡眠质量与阿尔茨海默病(AD)密切相关,高达80%的AD患者存在昼夜节律紊乱问题。
在四年前,波士顿大学的研究人员发现,高质量睡眠的脑电波节律有助于脑脊液进入大脑,并“清洗”大脑中的有害代谢物[1]。
前不久,来自圣路易斯华盛顿大学的研究人员,首次基于人体血液和脑脊液样本证实:睡眠不足可能削弱了脑脊液将有害蛋白排进血液的能力,最终导致脑脊液中有毒蛋白增加[2]。
如果将两个研究连在一起,就会发现,睡眠问题不仅会导致大脑中的有害物质不能进入脑脊液,还会导致脑脊液中的有毒物质无法排入血液。
好消息来了。
近日,由加州大学圣地亚哥分校Paula Desplats领衔的研究团队,在著名期刊《细胞·代谢》上发表重磅研究成果。他们首次发现,不限制热量的限时进食(TRF)不仅恢复了AD模式小鼠的昼夜节律和睡眠时长,还减轻了小鼠的AD病理负担,甚至改善了模式小鼠的记忆力[3]。

论文首页截图
近年来,限时进食的人体研究非常火热,已经有研究发现,限时进食可以改变人体皮质醇的昼夜模式,以及血液中昼夜节律时钟基因和自噬标志物的表达[4]。
还有研究在亨廷顿病模式小鼠身上发现,限时进食(6小时进食,18小时禁食)可以改善亨廷顿病小鼠的睡眠/觉醒周期、运动表现和炎症[5,6]。因此,Desplats团队想知道限时进食对AD是不是也有好处。
他们使用的小鼠模型是在6月龄左右开始出现进行性β淀粉样蛋白病理变化的APP23转基因小鼠(TG),对照组是非转基因的野生型小鼠(NTG)。
他们注意到,在小鼠11个月大的时候,与野生型小鼠相比,AD模式小鼠就会出现昼夜节律紊乱,失眠,平均总睡眠时间减少。海马体转录组测序结果表明,AD模式小鼠的AD病理学和海马神经炎症相关的许多基因的日间表达模式的严重失调。
为了了解限时进食是否可以恢复小鼠的昼夜节律,并改善小鼠海马的转录组节律。他们将小鼠分为两组,一组小鼠在活动期内6小时进食,剩余18个小时禁食;另一组自由进食,作为对照;研究持续3个月。初步看来,各组小鼠的食物摄入量和体重没有差异,说明限时进食没有降低小鼠摄入的热量,排除了热量的影响。
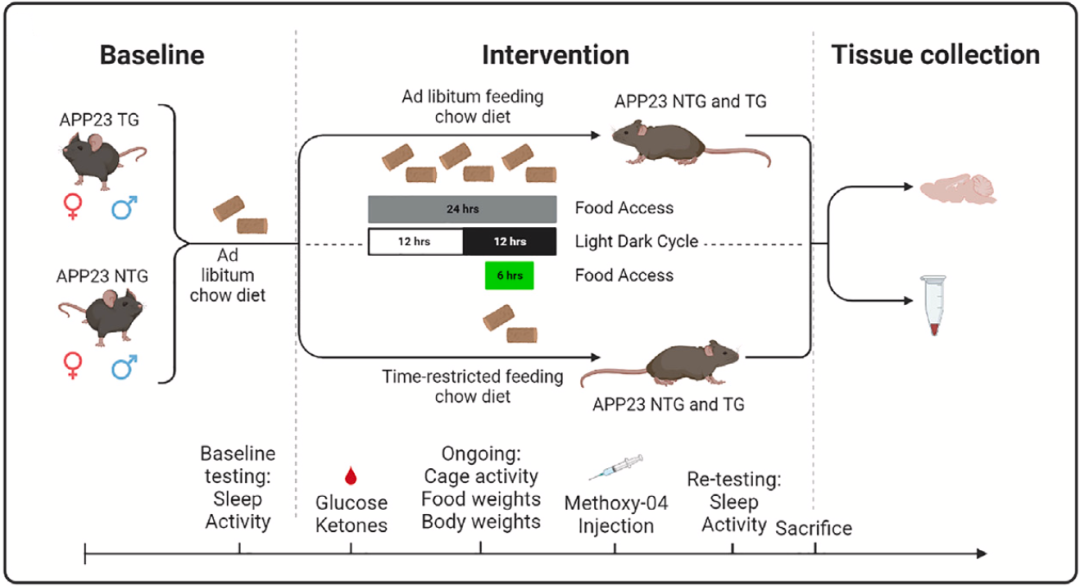
研究流程图
从研究结果来看,无论是雄性AD小鼠,还是雌性AD小鼠,与自由进食组相比,限时进食组小鼠的入睡阶段都改善了。不过在总睡眠时长上,雌性AD小鼠恢复到野生小鼠的水平;但是雄性AD小鼠却没啥变化。
值得一提的是,限时进食逆转了雌性和雄性AD小鼠的特定行为异常,它们不再表现出活动期过度活跃,活动模式变得与野生型小鼠无异。
Desplats认为,限时进食改善了AD小鼠的睡眠,并使它们的活动节律恢复正常。
接下来的转录组分析发现,限时进食使AD小鼠海马中与AD、神经炎症、脂质处理和自噬相关的基因转录模式正常化。
更重要的是,限时进食减轻了AD小鼠的病理负担:Aβ斑块大小减小,数量也减少了。值得注意的是,限时进食不仅限制了新斑块形成的速度,还会诱导已经存在斑块的消除。
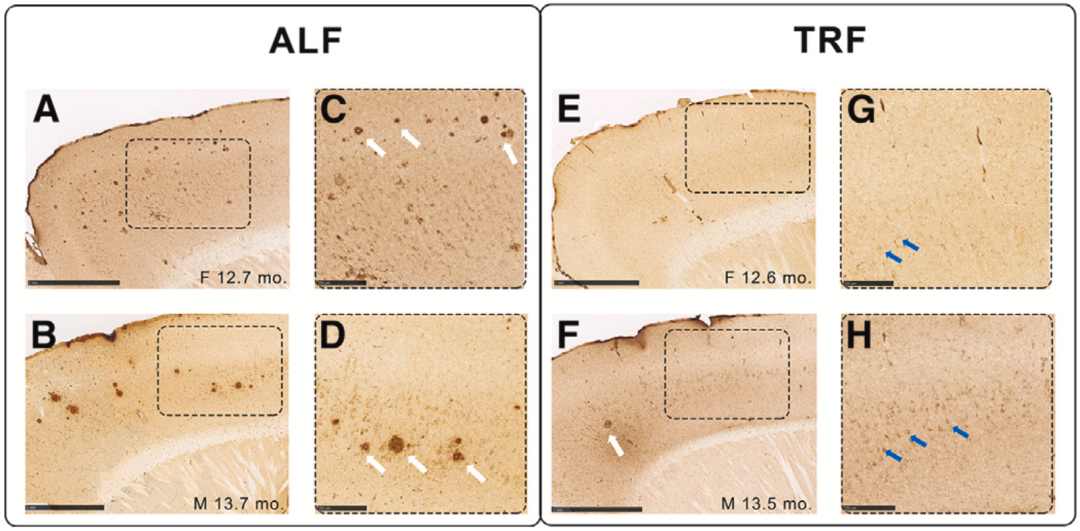
与自由进食(ALF)相比,限时进食可以降低AD病理负担
最让人激动的还是,限时进食改善了AD模式小鼠(APP-KI)的认知能力,使其认知能力恢复到接近野生小鼠的水平。这意味着,限时进食具有潜在的临床转化价值。
总的来说,Desplats团队的这一研究成果首次表明,通过限时进食调节AD模式小鼠的昼夜节律,可以改变诱发AD的关键通路,进而改善模式动物的认知。
这一发现对AD患者而言,无疑是个好消息。如果后续的临床研究能复现这个研究的结果,那么未来就可以在AD高危人群出现睡眠问题时实施饮食干预,防治疾病的进展。
非常期待相关的临床研究。
参考文献:
[1].Fultz NE, Bonmassar G, Setsompop K, et al. Coupled electrophysiological, hemodynamic, and cerebrospinal fluid oscillations in human sleep. Science. 2019;366(6465):628-631. doi:10.1126/science.aax5440
[2].Liu H, Barthélemy NR, Ovod V, et al. Acute sleep loss decreases CSF-to-blood clearance of Alzheimer's disease biomarkers. Alzheimers Dement. 2023;19(7):3055-3064. doi:10.1002/alz.12930
[3].Whittaker DS, Akhmetova L, Carlin D, et al. Circadian modulation by time-restricted feeding rescues brain pathology and improves memory in mouse models of Alzheimer's disease. Cell Metab. 2023;S1550-4131(23)00273-5. doi:10.1016/j.cmet.2023.07.014
[4].Jamshed H, Beyl RA, Della Manna DL, et al. Early Time-Restricted Feeding Improves 24-Hour Glucose Levels and Affects Markers of the Circadian Clock, Aging, and Autophagy in Humans. Nutrients. 2019;11(6):1234. Published 2019 May 30. doi:10.3390/nu11061234
[5].Wang HB, Loh DH, Whittaker DS, et al. Time-Restricted Feeding Improves Circadian Dysfunction as well as Motor Symptoms in the Q175 Mouse Model of Huntington's Disease. eNeuro. 2018;5(1):ENEURO.0431-17.2017. doi:10.1523/ENEURO.0431-17.2017
[6].Whittaker DS, Loh DH, Wang HB, et al. Circadian-based Treatment Strategy Effective in the BACHD Mouse Model of Huntington's Disease. J Biol Rhythms. 2018;33(5):535-554. doi:10.1177/0748730418790401
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


