《自然·医学》综述:阿尔茨海默病的诊疗迎来新时代了吗?
来源:代丝雨 2023-09-26 11:13
我们对AD发生发展的认知已经与前人大大不同,基于液体活检的生物标志物研究和新药的临床结果带来了AD领域内一阵新风,以此为基点,AD诊疗将走入全新的时代。
人类世界正面临着避无可避的老龄化浪潮。
从20世纪初至今,医学和公共卫生的发展大大拉长了人类寿命。根据世界卫生组织的预测,2030年,世界1/6的人口将为60岁以上的老年人,而这个数字到2050年还会翻倍。
与老龄化同时到来的,就是各种与年龄相关的非传染性疾病的高企,例如痴呆的主要病因,阿尔茨海默病(AD)。
长期以来,AD陷于病因和治疗的双重困境。但时至今日,我们对AD的了解已经大幅度拓展,对病理的探索、有效生物标志物的发现以及新药的成功,都给AD带来了全新的观察视角。
近期,AD领域大牛学者David M. Holtzman在《自然·医学》杂志发表综述文章,对AD生物标志物和临床治疗的新进展进行了介绍,尤其是临床试验中新药的表现,想必能够为诸位读者带来更有现实意义的讨论。

从细微之处见病理——生物标志物的新进展
AD具有颇为复杂的病理表现,如神经斑块沉积、神经元纤维缠结形成、神经炎症、突触/神经元丧失和脑萎缩。为病因探寻雪上加霜的是,异常淀粉样蛋白沉积发生在疾病症状出现前几十年,而tau蛋白聚集也在认知障碍出现几年前就已经在新皮层默默发生。
想要追寻这些隐秘的踪迹,生物标志物技术是必须的。
FDA已经批准了正电子发射断层扫描(PET)示踪剂来识别淀粉样斑块沉积和tau缠结,以协助AD诊断。在临床前研究中,这两种病理的不同神经毒性和相互作用方式则给我们留下了更多谜题。
丨淀粉样蛋白级联假说,“显形”!
诸多研究证据表明,β淀粉样蛋白(Aβ)是AD进展的关键,因而也有学者针对性地提出了“淀粉样蛋白级联假说”,可简要理解为Aβ沉积是导致tau蛋白过度磷酸化、神经元纤维缠结和神经变性的必要事件。
神经影像学研究的结果让我们能够更清楚地明白Aβ和tau这两种病理之间的时空关系。
PET成像结果表明,全脑Aβ阳性+颞部皮质区tau纤维阳性可用于预测认知正常的老年人是否会发展为AD;横断面研究和纵向神经成像数据分析表明,淀粉样蛋白和tau阳性脑区之间存在远程相互作用,这有助于tau病理的扩散。
近期的临床前研究证据对二者的远程相互作用给出了更详细的分子机制解释,例如淀粉样斑块相关的神经学营养不良会破坏神经网络功能,且可作为淀粉样斑块相关的tau聚集和朊病毒样扩散的核心。
越来越多的研究证据说明,Aβ和tau病理之间的相互作用在AD的发病机制中很重要。
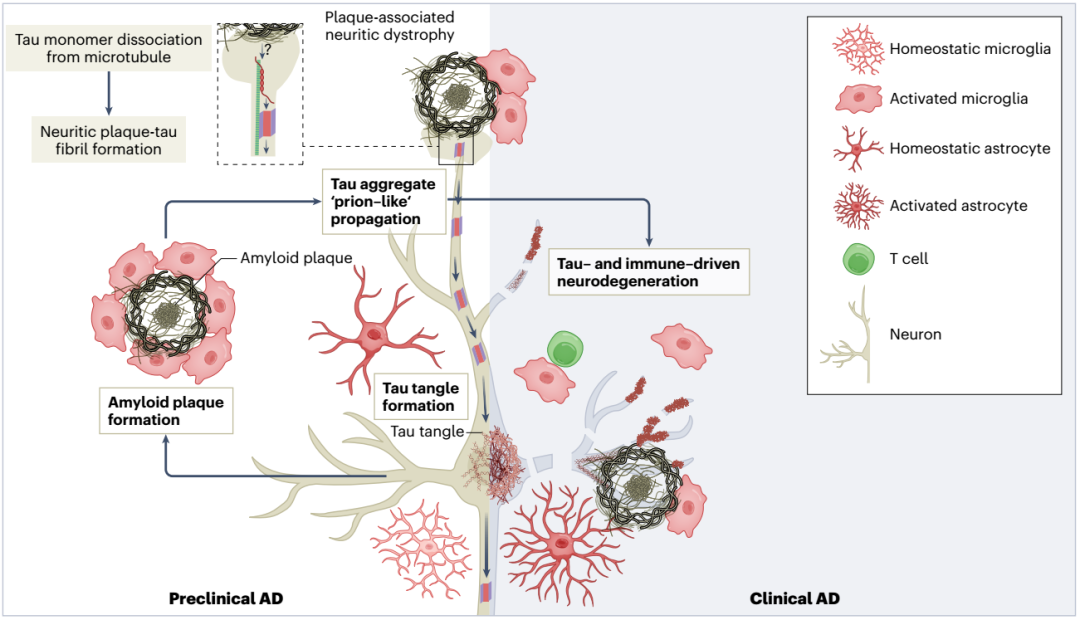
Aβ与tau病理在AD中的机制和互作
通过结合转运蛋白示踪剂,神经影像学方法也可以用于了解小胶质细胞在AD进展中的作用。小胶质细胞与tau病理扩散密切相关,淀粉样蛋白、tau和小胶质细胞的阳性结果可用于预测AD相关认知障碍。这也提示我们,在AD的发生和进展中,免疫系统以及神经炎症的重要作用。
遗憾的是,神经影像学工具价格实在高昂,对基础设施的要求也比较高,这限制了临床中的广泛应用。在这样的背景下,基于体液的生物标志物就显得更为可贵了。
丨以血为鉴
脑脊液(CSF)和血浆中生物标志物检测的灵敏度已经接近神经影像学。已有诸多经过验证的Aβ、tau、神经炎症蛋白、神经功能障碍和变性的生物标志物,可用于AD的病理检测、与其他神经退行性疾病区分、预测认知能力下降。
淀粉样蛋白
Aβ42更容易沉积,脑脊液Aβ42与Aβ40的比值是脑内斑块的有效指标,且与PET成像结果相当。FDA已经批准两款脑脊液Aβ的体外检测产品。血浆中Aβ42/Aβ40比值与脑脊液及PET结果高度一致,同时具有更小的侵入性、更具成本效益。
tau蛋白
tau蛋白的多种翻译后修饰产物是有力的生物标志物。ptau181是发现的第一个磷酸化tau产物,也被认为是磷酸化tau蛋白测量的金标准。FDA已经批准了一项针对ptau181的测试以辅助AD诊断。此外,ptau217、ptau231也是备受关注的tau蛋白过度磷酸化标志物。
近期研究发现,细胞外tau亚型与tau聚集特异性有关。脑脊液中tau蛋白微管结合区(MTBR)与PET tau和认知下降成正相关;tau368/总tau与PET tau成负相关,冷冻电镜成像结果显示,368位氨基酸存在于AD tau蛋白丝的核心,支持了tau368减少是tau蛋白聚集标志物的观点。不过,目前尚未有研究在血浆中发现MTBR tau或tau368。
总的来说,脑脊液有望作为tau相关生物标志物的来源,但目前血浆成分尚未被证实可以反映大脑中tau蛋白的聚集。
神经炎症
神经炎症最常用的生物标志物是胶质原纤维酸性蛋白(GFAP),由星形胶质细胞表达。在AD中,GFAP升高与淀粉样蛋白阳性相关。有趣的是,血浆中GFAP浓度变化幅度大于脑脊液,它也是目前唯一的血浆检测优于脑脊液的AD相关生物标志物。
小胶质细胞在AD进展中有重要作用,它表达的TREM2等蛋白与Aβ和tau存在一定的关系,但它们在其他细胞中的表达混淆了作为脑特异性标志物的作用。目前还没有经过验证的小胶质细胞相关标志物。
另外,基于细胞术的检测也是一种值得期待的新方向,可以通过细胞因子、趋化因子和特定的免疫细胞群确定不同AD进展阶段的特异性免疫系统失调。
神经功能障碍和神经变性
AD患者脑脊液中,神经元正五聚蛋白2(NTPX2)减少、神经粒蛋白和SNAP-25增加。细胞骨架蛋白神经丝轻链(NfL)是各种神经退行性状态的神经标志物。在AD临床前阶段中,脑脊液和血浆NfL水平升高,但它与Aβ和tau病理之间的关系在痴呆晚期更加明显。
AD治疗的新时代
最近几年,抗Aβ被动免疫治疗接连传来好消息,2/3期临床研究的积极数据不禁令人充满期待。不过,相对来说较小的治疗收益和隐含的安全问题也是实际应用时必须考虑的。
针对其他途径,例如抗tau或抗炎的疗法也取得了一定的进展。
丨Aβ
过去20年里,Aβ是AD最受关注的靶点,也是最受打击的靶点。β分泌酶和γ分泌酶在临床试验中未能表现出比安慰剂更好的效果,这可能是由于Aβ单体也具有一定的生理作用,以及分泌酶同时抑制了下游多个不同的Aβ。
目前进入3期临床的抗Aβ单抗可见下表。
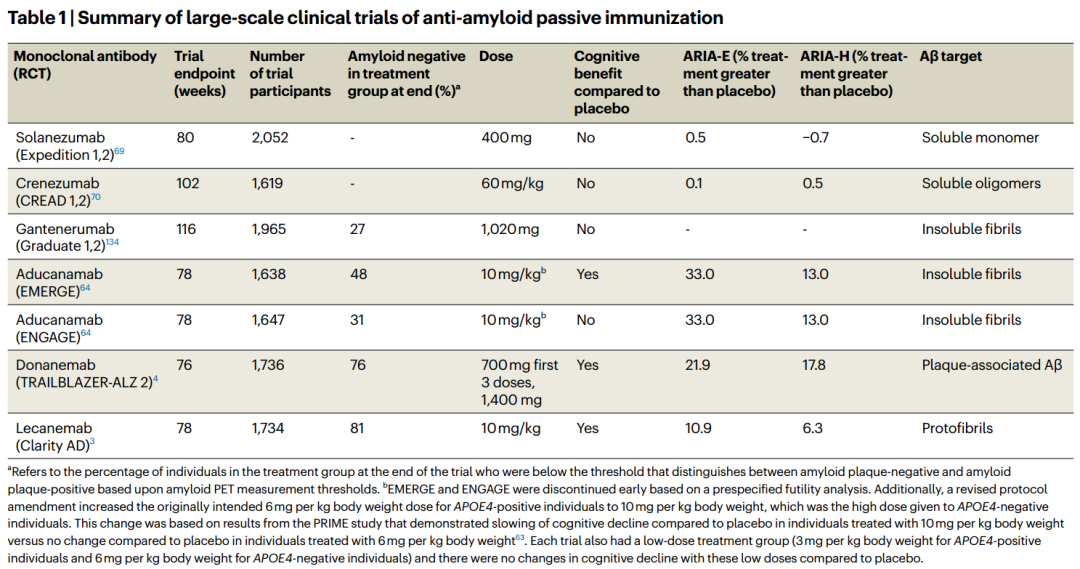
针对可溶性Aβ单体的solanezumab和crenezumab未能在3期临床中取得认知收益。
首个获批的aducanumab颇有争议。在EMERGE和ENGAGE两项研究中,高剂量组的主要认知终点结果不一。
lecanemab的ClarityAD是首个明确展示了临床效果的3期临床研究,18个月治疗使MCI和轻度AD患者CDR-SB评估的认知能力下降减少了27%,多项认知和日常生活活动能力下降减缓了25-40%。
类似的,donanemab的TRAILBLAZER-ALZ 2也表现出了延缓早期认知和功能衰退的效果。
在这些试验中可见一致的观察,临床收益普遍出现在治疗开始后18个月,且与PET检测的脑淀粉样蛋白斑块负荷减轻有关。目前还不清楚18个月是否已经实现了最大治疗改善,为了保持获益,是否需要持续治疗?我们还不知道。
抗Aβ单抗的又一问题是安全性。淀粉样蛋白相关成像异常(ARIA)是其主要不良事件,携带APOE4则增加了ARIA的风险。有研究认为,ARIA是抗Aβ单抗诱导淀粉样脑血管病(CAA)相关炎症的结果。或许,同时去除CAA和实质淀粉样斑块是避免ARIA的有效手段。
丨tau
针对tau的治疗策略多种多样,包括特异性去除病理性tau蛋白亚种,减少tau的产生,通过稳定微管或抑制翻译后修饰来促进tau的生理功能。不过遗憾的是,目前还没有tau靶向治疗在临床前或早期AD中展现出明确的疗效。
一种可能的解释是,这些手段都无法有效阻止神经元内部有毒形式的tau蛋白的积累。
目前正在开发的下一代抗tau主动或被动免疫方法,通过靶向翻译后修饰表位或微管结合区表位来特异性针对tau的病理形式,而非最初采取的针对tau N端表位的泛靶向方式。不过这是否能够深入神经元细胞质,又或是仍旧只能处理细胞外空间的病理tau还未可知。
另一种思路是通过反义寡核苷酸(ASO)等降低全局tau表达。1b期研究已经证实了tau ASO在人体中的安全性,有效性的试验正在进行中。有报道称,tau ASO能够有效减少PET tau病理,这是否能够转化为认知收益还待后续揭露。
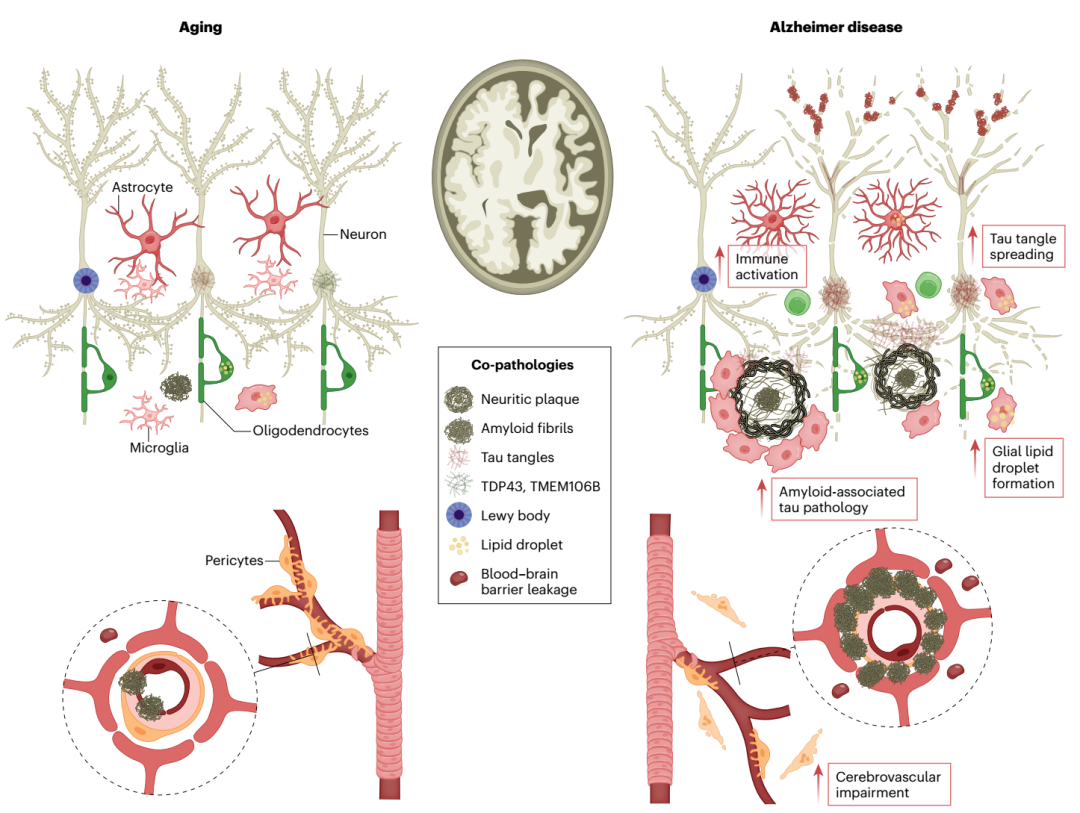
Aβ和tau之外的病理机制
丨神经炎症
神经炎症也是目前较为受到关注的靶点。例如TREM2,作为控制小胶质细胞状态的重要分子,TREM2激活在AD的不同阶段表现出减轻或加剧病理的双面效应。TREM2功能丧失突变是迟发性AD的危险因素,TREM2激活剂也成为AD治疗的方向之一。不过,在不同的临床前模型中,TREM2激活剂表现出的作用并不一致,尤其是在tau病理存在的情况下,TREM2激活剂或会促进神经元丢失。
小胶质细胞胞葬作用(efferocytosis)可能是一个有效的新靶点,与吞噬作用不同,胞葬途径具有抗炎和促进组织修复的作用。近期有研究发现了一种在在吞噬细胞上嵌合抗原受体来促进胞葬的方法,这或许能够用于AD相关病理的清除。
APOE也参与小胶质细胞反应,它能够影响小胶质细胞和星形胶质细胞的交叉作用,从而协调对AD病理的先天免疫。选择性去除星形胶质细胞和神经元中的APOE可以防止tau介导神经退行性病变小鼠的神经元丢失,使用APOE ASO治疗也能减少脑损伤模型中的神经元丢失和脑萎缩。靶向APOE在减少Aβ积累上并未表现出效果,但针对神经炎症反应的效果是非常不错的。
外周免疫也成为了AD的新靶点,例如脑膜淋巴功能障碍、脑膜巨噬细胞、脑脊液血流动力学脑实质中的适应性免疫等等都值得一究。
丨其他病理
在Aβ、tau、神经炎症等主要病理表现之外,还有很多会影响AD进展的因素,例如大脑中的多种衰老相关共病。它们与Aβ和tau之间的关系尚不清楚,可能独立地导致认知能力下降,并给AD发展带来异质性。将α-突触核蛋白和TDP-43等生物标志物纳入当前AD标志物纵向分析,或许能够为我们提供新的视角。
通过单细胞测序技术和空间转录组学等技术,研究人员已经对中枢各类细胞之间的复杂相互作用有了广泛的理解,这些认知将为我们带来新的治疗靶点。有趣的是,许多广泛失调的分子或细胞途径会受到AD遗传风险和生活方式因素的影响,而这也能够成为干预的目标。
总而言之,我们对AD发生发展的认知已经与前人大大不同,基于液体活检的生物标志物研究和新药的临床结果带来了AD领域内一阵新风,以此为基点,AD诊疗将走入全新的时代。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


