Cell子刊:中山大学林园/梁剑开团队证实溶瘤病毒可增强DC疫苗抗肿瘤效果
来源:生物世界 2023-10-12 10:03
这些发现强调了溶瘤病毒OVM作为SIRPα/CD47免疫检查点轴的双重抑制剂的关键作用,表明了溶瘤病毒联合DC疫苗在未来作为新的癌症治疗方法的潜力。
中山大学中山医学院林园、梁剑开等人在 Cell 子刊 Cell Reports Medicine 上发表了题为:Oncolytic virus M1 functions as a bifunctional checkpoint inhibitor to enhance the antitumor activity of DC vaccine 的研究论文。
该研究证明,新型溶瘤病毒——甲病毒M1(OVM)可以通过增加肿瘤微环境中CD8+效应T细胞的浸润来增强DC疫苗的抗肿瘤效果。从机制上说,肿瘤细胞通过SIRPα-CD47免疫检查点对抗DC疫苗,而OVM可以下调DC中的SIRPα和肿瘤细胞中的CD47表达。此外,由于OVM上调了DC中的PD-L1,因此,将抗PD-L1抗体与DC疫苗和OVM疗法三合一,能够进一步增强抗肿瘤活性,可作为一种很有希望的恶性肿瘤治疗策略。
总的来说,这项研究表明,溶瘤病毒M1(OVM)通过下调SIRPa-CD47的表达,解除其对DC疫苗的显性免疫抑制作用,进而增强DC疫苗的抗肿瘤效果,这为OVM作为DC疫苗强效佐剂的临床试验奠定了理论基础。

2010年,FDA批准了第一款基于DC的自体癌症疫苗——sipuleucel-T(Provenge),用于治疗前列腺癌。在临床上,DC作为一种新型的免疫治疗工具,在治疗多种肿瘤方面具有广阔应用前景。迄今为止,全球已开展400余项基于DC疫苗的临床研究,旨在治疗多种肿瘤类型,包括胶质母细胞瘤、急性髓系白血病、转移性结直肠癌、胰腺癌、高危黑色素瘤等。临床研究中大多采用单核细胞来源的树突状细胞(Mo-DCs)来生成DC疫苗,其诱导纯度高,且相对容易从外周血中获得足够的细胞。
虽然DC疫苗可以诱导肿瘤特异性T细胞,但其疗效仍然有限,主要原因是肿瘤中的免疫抑制性肿瘤微环境(TME)以及肿瘤抗原表达不足。一方面,肿瘤细胞降低DC趋化因子或细胞因子的表达,限制DC的生存、迁移和浸润,并产生抑制因子抑制DC的分化和成熟。此外,在DC表面表达的免疫检查点(例如PD-1、PD-L1和TIM-3)也削弱了其功能。
另一方面,肿瘤的低免疫原性和肿瘤相关抗原(TAA)的低暴露使识别理想的肿瘤特异性抗原变得更加困难,而这些抗原在DC疫苗的制备中至关重要。这些影响导致肿瘤微环境(TME)中内源性DC的T细胞启动功能较差,可能限制DC疫苗的抗肿瘤效果。因此,克服TME的抑制作用,促进TAA的释放是提高DC疫苗治疗效果的潜在策略。
溶瘤病毒疗法是一种利用自然存在的或基因修饰的病毒选择性杀死肿瘤细胞,而对正常细胞没有毒性的策略,在临床和临床前研究中显示出有希望的效果。据报道,溶瘤病毒疗法也可以逆转肿瘤免疫抑制,促进抗原释放和递呈,产生抗肿瘤免疫,并与其他癌症免疫疗法联合使用取得显著疗效。
因此,溶瘤病毒可能有能力减轻TME的抑制作用,增强DC疫苗的效力。此外,溶瘤病毒可以诱导I型干扰素(IFN)通路,促进IFN-α/β的分泌,这是DC功能和向适应性免疫反应过渡所必需的。
甲病毒M1(OVM)是一种靶向MXRA8蛋白过表达和ZAP蛋白缺陷的肿瘤细胞的新型天然溶瘤病毒,对非人灵长类动物无致病性。此外,一系列研究也报道了OVM可以显著增加肿瘤微环境(TME)中T细胞的浸润,进一步提高免疫检查点阻断疗法在各种荷瘤小鼠模型中的抗肿瘤作用。然而,OVM是否具有增强DC疫苗抗肿瘤效果的潜力尚未得到研究。
在这项研究中,研究团队发现,新型溶瘤病毒OVM强烈提高了DC疫苗对各种小鼠肿瘤模型的抗肿瘤效果。
该研究进一步确定了SIRPα/CD47轴是肿瘤细胞如何抑制DC成熟和DC疫苗效果的关键免疫抑制机制。使用OVM治疗可以下调DC表面的SIRPα和肿瘤细胞表面的CD47表达水平,从而减轻对DC的抑制,恢复其启动T细胞反应的功能。此外,OVM还可以诱导DC中PD-L1的表达增加,使用抗体阻断PD-L1,能够进一步增强OVM和DC疫苗联合疗法的抗肿瘤疗效。
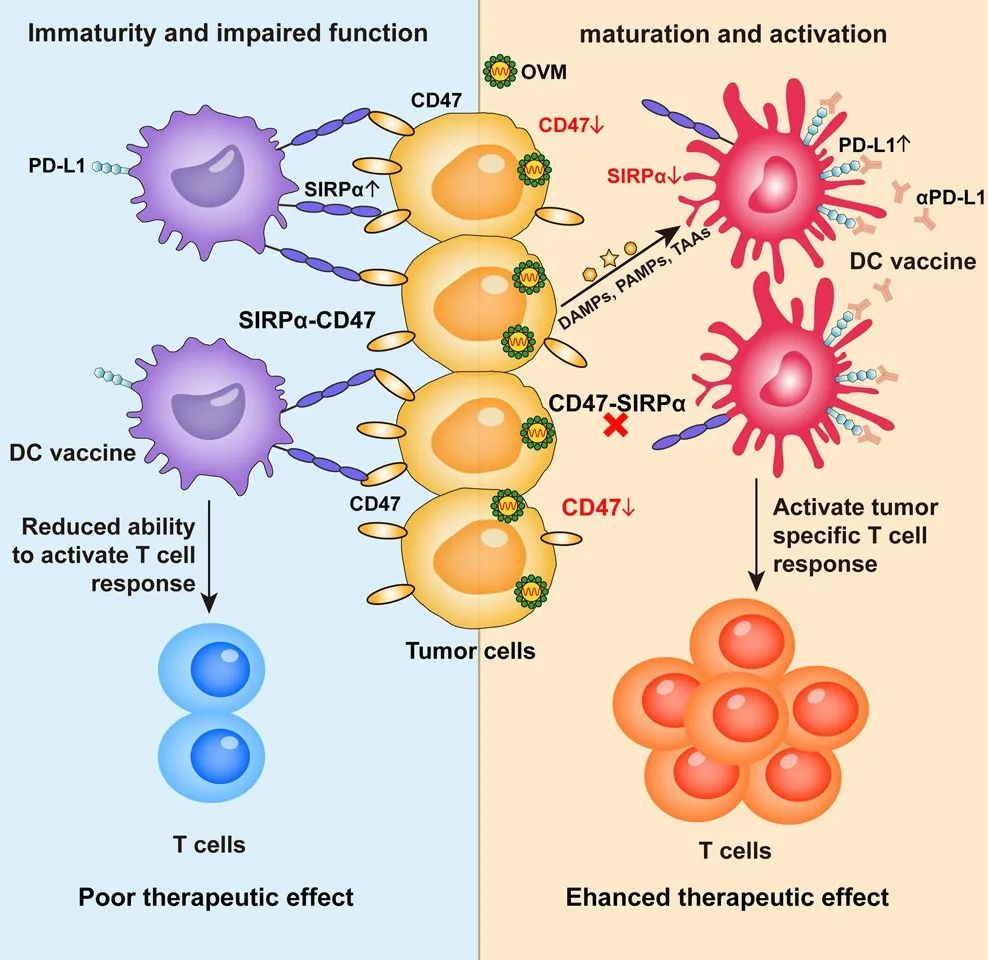
这些发现强调了溶瘤病毒OVM作为SIRPα/CD47免疫检查点轴的双重抑制剂的关键作用,表明了溶瘤病毒联合DC疫苗在未来作为新的癌症治疗方法的潜力。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


