NAR:揭示pH值影响幽门螺旋杆菌在发炎胃部组织中粘附的分子机制
来源:生物谷原创 2024-04-07 17:19
该研究揭示了酸性条件下ArsR-P精确抑制转录的关键分子机制,这种转录调控可能介导Hp在胃粘膜层定位的微妙变化,为深入理解Hp致病特性的研究奠定了重要基础。
幽门螺旋杆菌(Helicobacter pylori,Hp)能够在人体胃部极端酸性环境中长期存活,其适应pH变化的能力至关重要。其中,酸反应双组分系统ArsRS构成了一种应对酸性环境的全局调控网络,然而,ArsRS如何精细调控转录过程的分子机制尚未得到充分解析。
近日,一篇发表在国际杂志Nucleic Acids Research上题为“Molecular insights into the fine-tuning of pH-dependent ArsR-mediated regulation of the SabA adhesin in Helicobacter pylori”的研究报告中,来自于默奥大学等机构的科学家们通过研究,揭示了Hp与炎症性胃部组织相互作用的分子细节及其受胃部pH值调控的具体机制。研究人员指出,深入理解Hp如何在胃内建立持久、终身感染,对于识别触发疾病的关键特征至关重要。
Hp感染一旦确立,若未经适当治疗,将持续终生,引发消化性溃疡乃至胃癌。胃内环境并非恒定,而是经历广泛的pH波动,从胃腔内的强酸环境到被粘液层保护的胃上皮细胞表面接近中性的微环境。Hp主要定殖于粘液层或紧贴上皮细胞外侧,其基因表达广泛受到pH感应调节,从而根据局部环境pH动态调整蛋白质产量。
 揭示pH值影响幽门螺旋杆菌在发炎胃部组织中粘附的分子机制
揭示pH值影响幽门螺旋杆菌在发炎胃部组织中粘附的分子机制
图片来源:Nucleic Acids Research (2024). DOI:10.1093/nar/gkae188
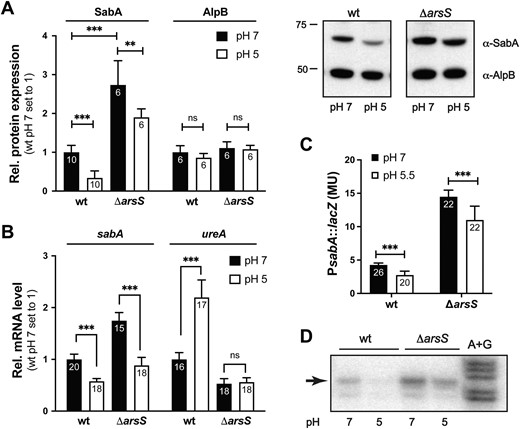
幽门螺旋杆菌的表面存在称之为粘附素(adhesins)的粘附蛋白,其往往作用于粘液层或最外层的细胞层,SabA蛋白就是其中一种粘附素,其能促使细菌粘附在发炎的胃粘膜上。这项研究中,研究人员在分子水平上阐明了pH是如何影响SabA蛋白的产生,在低pH下,调节性蛋白ArsR会被磷酸化并形成复合体。
本文研究揭示了ArsR复合体的两个结合位点,并强调了DNA拓扑结构对于ArsR结合的重要性。此外,研究人员还识别出了pH调节ArsR蛋白复合体中的ArsR结合位点,研究者指出,不同幽门螺旋杆菌菌株之间特定的DNA区域的差异或许会影响pH调节的SabA表达。
研究过程中,科研团队面临的主要技术挑战在于Hp的遗传改造。由于其基因结构复杂,这一过程既技术要求高又耗时颇多。尽管曾尝试委托国际专业公司进行设计,历经四个月多次尝试,最终未能成功。
值得注意的是,Hp倾向于定植于胃底部,此处pH值较胃体中段略高,后者富含产酸细胞,导致更低的pH。长期研究已揭示胃体(胃中段)Hp感染与胃癌风险的关联。更深入理解pH如何影响Hp粘附等基本特性,将有助于揭示其何种特征更易引发疾病。
综上所述,该研究揭示了酸性条件下ArsR-P精确抑制转录的关键分子机制,这种转录调控可能介导Hp在胃粘膜层定位的微妙变化,为深入理解Hp致病特性的研究奠定了重要基础。
参考文献:
Anna Åberg, Pär Gideonsson, Abhayprasad Bhat, et al. Molecular insights into the fine-tuning of pH-dependent ArsR-mediated regulation of the SabA adhesin in Helicobacter pylori, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae188
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


