Nat Commun | 韩晓/李锴发现M2巨噬细胞促进米色脂肪生成的潜在机制
来源:生物探索 2024-03-03 10:48
该研究对小鼠进行了6-羟基多巴胺(6OHDA)介导的交感神经切除术,并确定根除巨噬细胞也抑制了这些去神经小鼠的产热。
南京医科大学韩晓及李锴共同通讯在Nature Communications发表题为“M2 macrophages independently promote beige adipogenesis via blocking adipocyte Ets1”的研究论文,本研究在小鼠中进行交感神经切除术并进一步根除皮下脂肪巨噬细胞,并发现这些巨噬细胞具有独立于交感神经系统的直接米色促进功能。研究进一步鉴定脂肪细胞Ets1是该过程中的重要介质。
抗炎M2巨噬细胞抑制脂肪细胞中Ets1的表达,转录激活线粒体生物发生,并抑制线粒体清除,从而增加线粒体数量并促进米色化过程。雄性脂肪细胞Ets1敲入小鼠完全不耐寒,而脂肪细胞中缺乏Ets1的雄性小鼠表现出增强的能量消耗,并且对高脂肪饮食引起的代谢紊乱具有抵抗力。总之,该研究阐明了M2巨噬细胞和脂肪细胞之间的直接通讯,并揭示了Ets1在响应巨噬细胞并负向控制线粒体含量和米色脂肪细胞形成方面的功能。

产热(棕色和米色)脂肪细胞的特征在于它们通过将线粒体呼吸与 ATP 合成解偶联来燃烧脂肪的独特能力。棕色脂肪细胞首先在啮齿动物和人类婴儿中被描述。然而,棕色脂肪组织的大小和活性在成人中降低,尤其是在肥胖和 2 型糖尿病患者中。最近的单细胞测序(sc-seq)显示,由冷应激和体育锻炼诱导的米色脂肪细胞起源于皮下脂肪内的特定祖细胞亚群。考虑到巨大的体表面积,利用这种“米色化”过程代表了一种有前途的方法,可以增加能量消耗和改善与肥胖相关的代谢疾病。
米色产热受交感神经系统(SNS)和脂肪组织巨噬细胞(ATM)的调节,但启动和维持这一过程的信号尚未完全阐明。皮下脂肪的交感神经纤维起源于腹腔神经节,腹腔神经节被冷激发。一旦被激活,这些纤维就会释放去甲肾上腺素(NE),然后与脂肪细胞β3肾上腺素能受体(AR)结合,并通过环AMP/蛋白激酶A(cAMP/PKA)途径激活产热。然而,交感神经切除的啮齿动物对冷应激具有完全的抵抗力,表明SNS分泌的NE并不仅仅负责产热脂肪活性的变化。
脂肪组织在各种代谢失调的情况下变得神经性(即神经突减少),目前讨论的ATM参与是米色脂肪生成的一个组成部分。趋同性研究表明,M2样巨噬细胞通过对SNS的影响来调节米色化,因为巨噬细胞中Irs2、Mecp2或分泌因子slit3的缺失会改变局部交感神经活性,从而影响米色化。有趣的是,另外有研究表明,巨噬细胞可能通过消除NE或分泌NE直接调节米色脂肪生成。然而,巨噬细胞本身可以合成和分泌NE的建议在后来的研究中受到质疑。
除NE,还有其他几种细胞因子,被报道靶向脂肪干祖细胞(ASPC)并调节米色脂肪生成。这些观察结果提出了一种可能性,即除了SNS介导的间接效应外,ATM还可能直接促进米色脂肪生成。如果是这样,悬而未决的问题是 ASPC/米色脂肪细胞如何对ATM做出反应并开启产热?
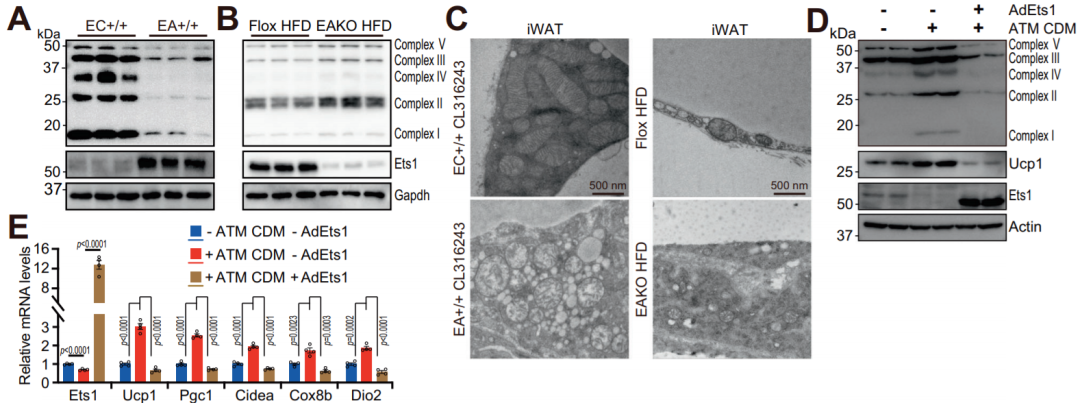
M2型巨噬细胞通过阻断Ets1增加脂肪细胞线粒体含量(Credit: Nature Communications)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


