GUT:中山大学联合大连化物所团队,破解蛋氨酸代谢在抗肿瘤免疫中的重要作用
来源:奇点糕 2022-08-19 18:06
甲硫氨酸(蛋氨酸)作为一种人体必需氨基酸,也是人体血浆中变化最大的代谢产物[1]。
甲硫氨酸(蛋氨酸)作为一种人体必需氨基酸,也是人体血浆中变化最大的代谢产物[1]。
蛋氨酸的摄取和代谢涉及许多细胞功能,包括甲基化反应、氧化还原维持、多胺合成和以及叶酸代谢[2]。在多数情况下,上述功能变化都与癌症发病机制相关。
此外,多项研究发现,从饮食中获得的蛋氨酸水平对肿瘤细胞蛋氨酸代谢有很大影响,这无疑在营养和肿瘤代谢之间搭建起了桥梁[3, 4]。这种受饮食影响的肿瘤特异性的代谢脆弱性,成为肿瘤治疗值得关注的一个方向。
肿瘤细胞对蛋氨酸“上瘾”,使得其在与T细胞的竞争中拔得头筹,这往往导致T细胞的蛋氨酸供给不足。虽然已有文章报道,在荷瘤小鼠瘤内注射蛋氨酸,改善T细胞代谢,可延缓肿瘤生长,而且这种方法与PD-L1抑制剂具有协同抗肿瘤作用[5]。
然而,蛋氨酸限制的饮食是否会影响ICB治疗效果尚未得到研究。此外,由于蛋氨酸在甲基转移酶的催化下会转化为甲基化供体S-腺苷甲硫氨酸(SAM),参与组蛋白甲基化、5-甲基胞嘧啶(5-mC)DNA甲基化和N6-甲基腺苷(m6A)RNA甲基化,目前尚不清楚蛋氨酸代谢、RNA甲基化和抗肿瘤免疫是否在分子上相互交织。
近日,由中山大学鞠怀强和徐瑞华及中国科学院大连化学物理研究所朴海龙领衔的研究团队,共同在国际著名期刊Gut上发表了他们关于蛋氨酸代谢对后续RNA甲基化及抗肿瘤免疫的研究[6]。
这个研究发现蛋氨酸代谢产生的SAM,可以促进肿瘤细胞中的m6A甲基化和免疫检查点蛋白(PD-L1,VISTA)的翻译,而蛋氨酸限制饮食(MRD)或m6A特异性结合蛋白YTHDF1的消耗,可以恢复肿瘤中CD8+T细胞的浸润,并与PD-1抑制剂产生协同作用,从而抑制肿瘤生长。
这意味着蛋氨酸和YTHDF1通过调节肿瘤浸润T细胞的效应功能,在抗癌免疫中发挥重要作用,而靶向蛋氨酸代谢或YTHDF1可能是癌症免疫治疗的潜在新策略。

论文首页
接下来我们就一起来看看这个研究是如何展开的。
研究人员分别构建了免疫健全小鼠和Rag2-/-免疫缺陷小鼠(缺乏成熟T,B细胞)的CT26和MC38(两种小鼠结直肠癌细胞)皮下瘤模型,并分别给予对照饮食(CD)或MRD,以探究蛋氨酸对抗肿瘤免疫的作用。
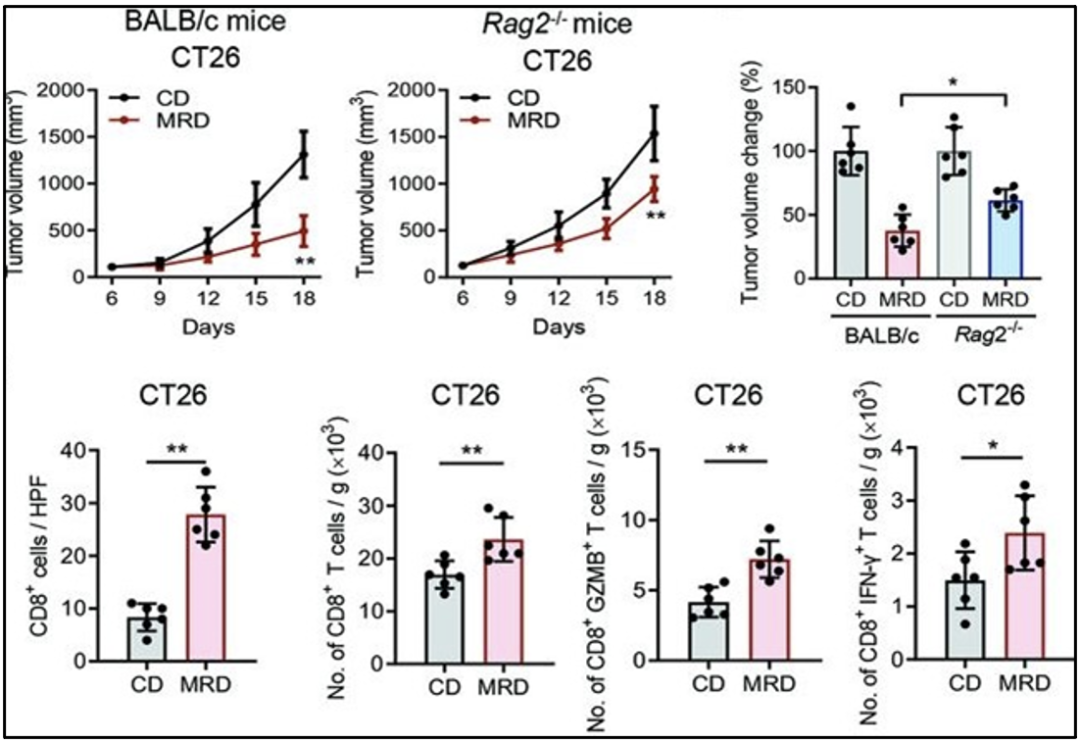
MRD处理抑制结直肠癌生长,促进瘤内CD8+T细胞的浸润及效应功能
他们发现虽然MRD喂养对免疫健全和Rag2-/-免疫缺陷鼠的肿瘤生长均有抑制作用,但这种抑制作用在免疫健全小鼠中更为明显,这表明MRD喂养主要通过适应性免疫发挥抗肿瘤作用。此外,与CD组相比,MRD组肿瘤中CD8+T细胞浸润,GZMB和IFN-γ信号增强。
在偶氮甲烷和葡聚糖硫酸钠(AOM-DSS)诱导的小鼠结肠炎相关结肠癌模型,及HCT116和HT29结肠癌细胞皮下异种移植的人源化小鼠模型中,研究人员也得到了上述结论。
为了搞清楚不同饮食方案究竟如何影响抗肿瘤免疫,研究团队开展了代谢组学分析,结果发现MRD喂养显著降低了肿瘤组织中蛋氨酸代谢产物的水平,且5-mC和m6A甲基化水平在肿瘤细胞也明显降低。这些结果表明,MRD喂养降低了肿瘤组织中甲基化供体SAM的水平,并可能间接破坏肿瘤浸润T细胞的效应功能。
由于DNA 5-mC修饰和RNA m6A修饰受到甲基转移酶、去甲基化酶和结合蛋白等一系列调节剂的调节。通过癌症基因组图谱(TCGA)数据库的相关性分析,研究人员发现CD8+T细胞浸润与一些调节因子的表达呈负相关,其中与m6A特异性结合蛋白YTHDF1负相关性最强,IHC分析也验证了上述结果。
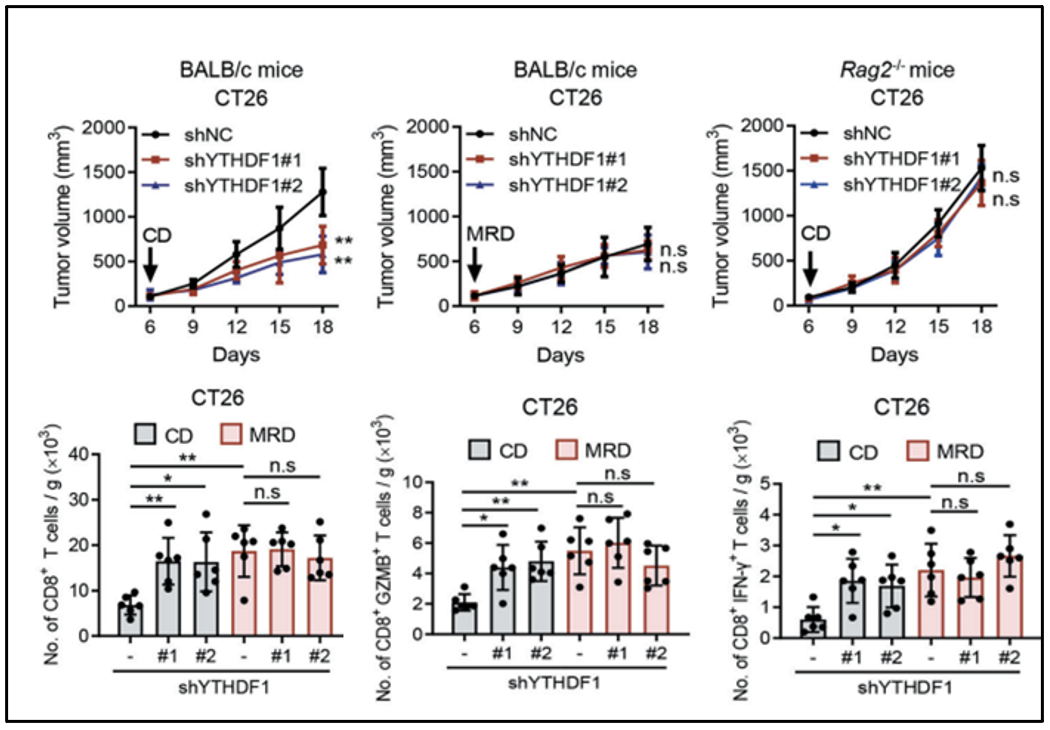
YTHDF1参与了MRD处理介导的适应性免疫反应
据此,研究人员将YTHDF1敲低的CT26和MC38细胞,接种到免疫健全小鼠或免疫缺陷Rag2-/-小鼠体内,分别喂食CD或MRD,并观察肿瘤的生长速度。他们发现YTHDF1作为一种免疫抑制分子,可以通过限制T细胞活化和细胞毒性来参与MRD介导的抗肿瘤效果,而肠道ythdf1条件缺陷的小鼠接受AOM-DSS处理时,结肠肿瘤形成的减少也证明了上述观点。
随后,研究人员进行了RIP-seq和与RIP-qPCR分析,发现YTHDF1的识别靶标为PD-L1和VISTA。他们猜想,YTHDF1可能以m6A依赖性方式调节PD-L1和VISTA的表达。
YTHDF1作为一种m6A“阅读器”蛋白,可以直接促进甲基化mRNA的翻译[7]。研究人员通过mRNA水平评估及多核糖体分析表明,敲低YTHDF1和蛋氨酸限制饮食不会影响PD-L1和VISTA的转录水平,而是导致PD-L1和VISTA的mRNA的翻译效率降低。这些结果表明YTHDF1可以促进PD-L1和VISTA的蛋白质合成。
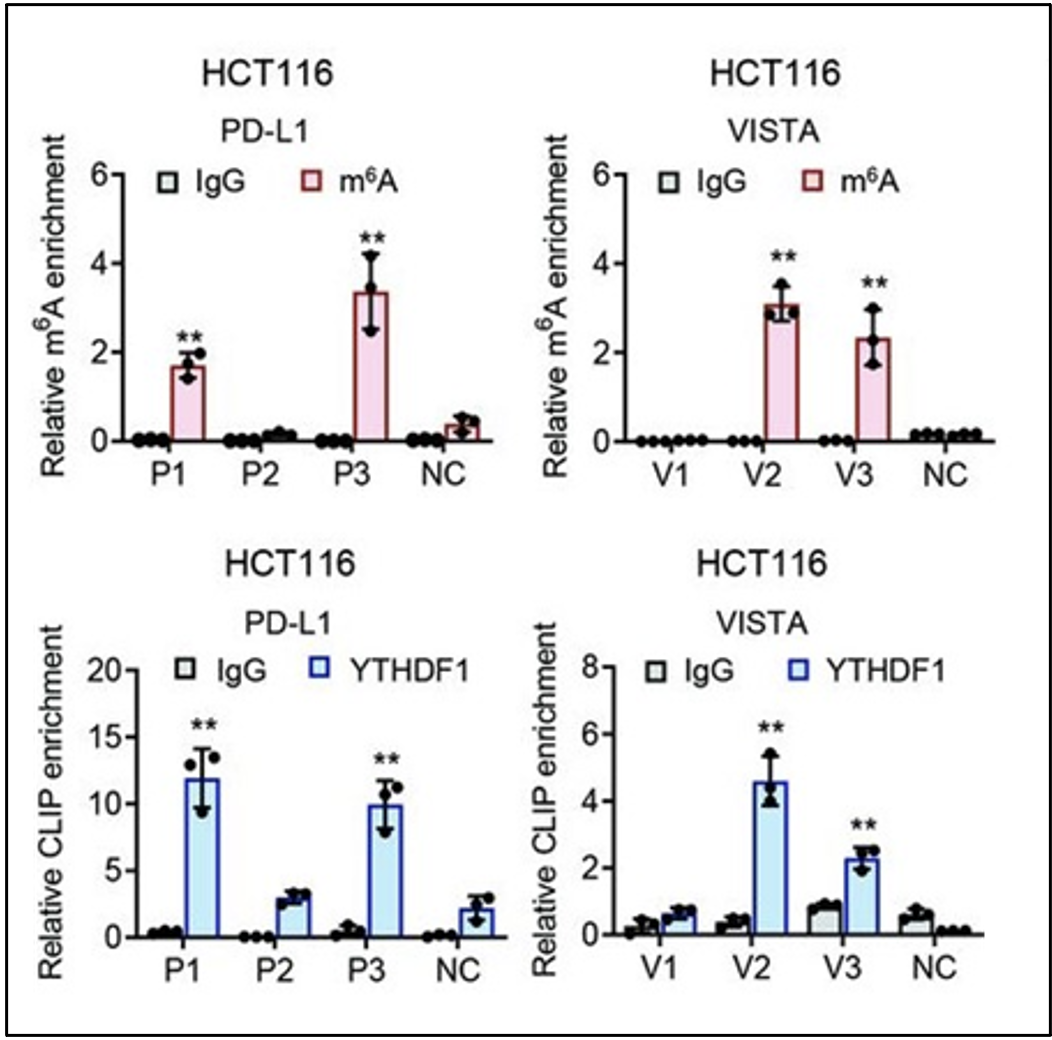
YTHDF1识别PD-L1与VISTA的m6A修饰位点
通过分析RIP-seq数据,并使用SRAMP工具预测PD-L1和VISTA转录本的m6A基序,筛选m6A修饰的潜在位点,随后借助MeRIP-qPCR和CLIP-qPCR进一步验证,研究人员确定了YTHDF1识别PD-L1和VISTA mRNA转录本中特定的m6A修饰位点。
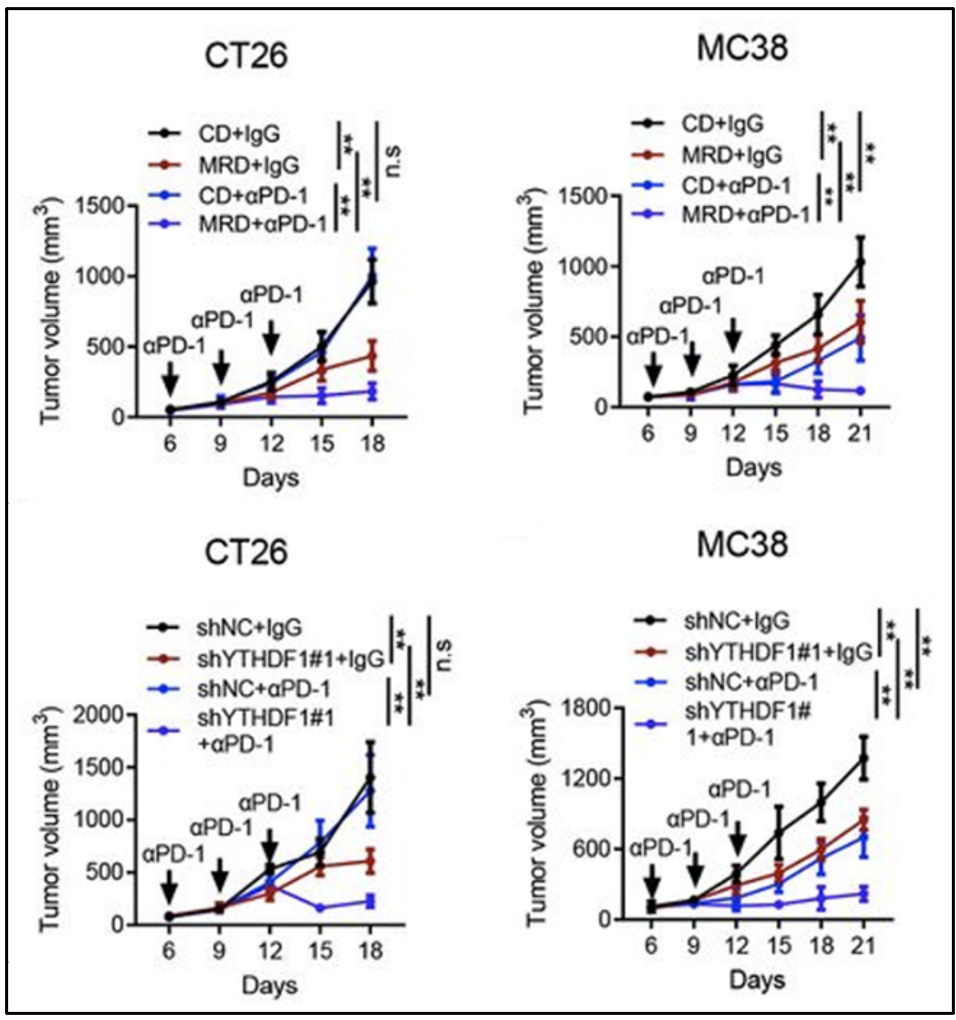
MRD处理及YTHDF1敲低均能增强PD-1抑制剂的疗效
基于上述发现,研究人员进一步发现CT26和MC38荷瘤小鼠在蛋氨酸限制饮食或敲低YTHDF1,能够增强ICB疗法(PD-1抑制剂)在小鼠模型中的抗肿瘤活性。
此外,研究人员利用RT-qPCR和IHC检查了CRC患者肿瘤组织中的YTHDF1表达,发现YTHDF1不仅在原发CRC组织中上调,而且在复发性CRC组织中也升高。MeRIP-qPCR还证实,PD-L1和VISTA转录本的m6A修饰水平在CRC组织中也显著增加。
通过分析患者YTHDF1的表达水平与生存期的关系,研究人员发现具有高YTHDF1表达水平的患者总生存期(OS)和无病生存期(DFS)更短,这意味着YTHDF1表达水平有助于判断患者能否对ICB治疗产生更大响应,证明其具有一定的临床意义。
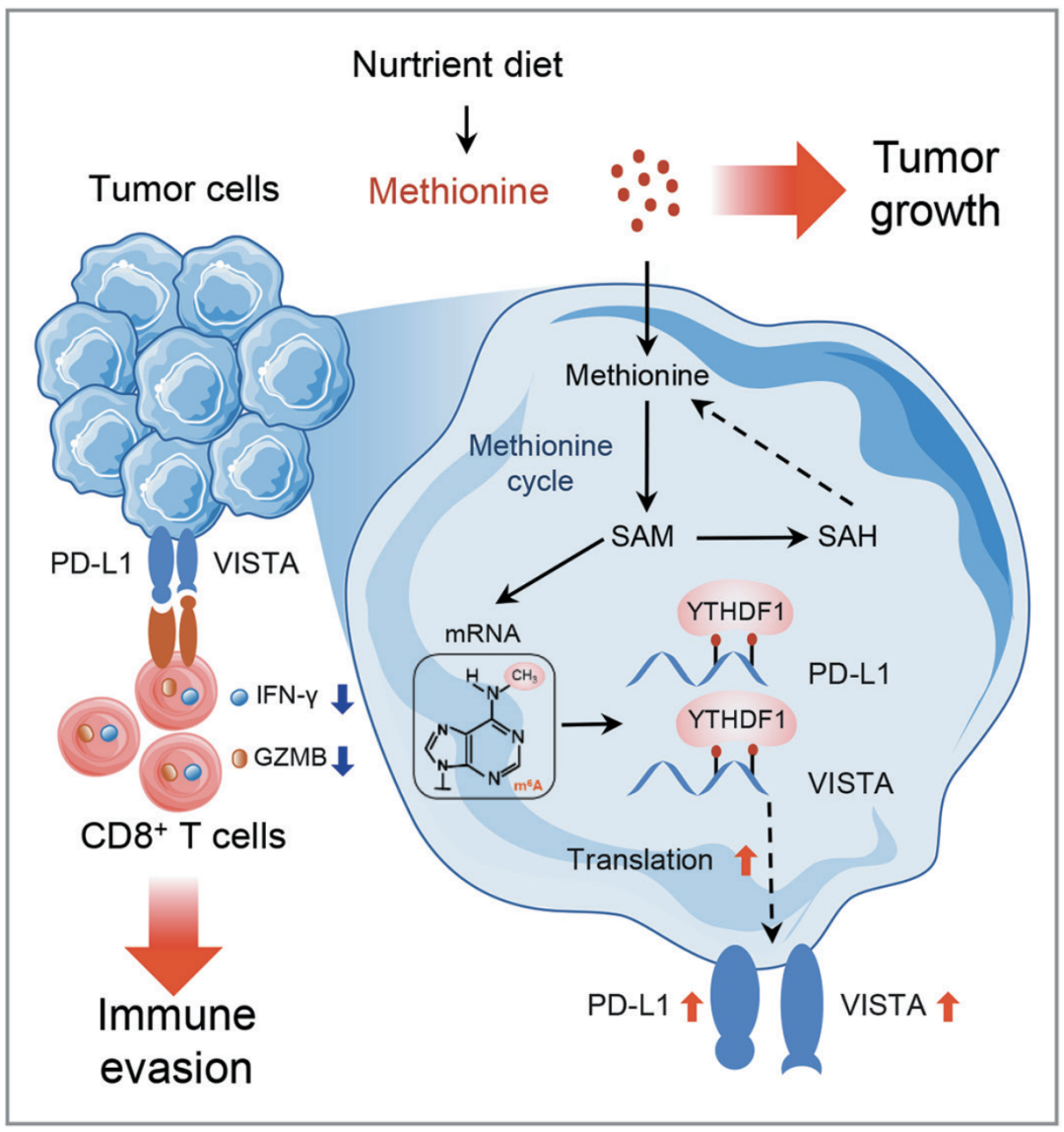 机制示意图
机制示意图
总的来说,该团队目前的研究不仅揭示了RNA m6A修饰在抗肿瘤免疫中的一种新的调控机制,而且强调了基于YTHDF1表达差异的蛋氨酸限制与PD-1抑制剂的组合策略,可以产生较好的生存效益。
除此之外,这个研究还有以下三个意义。首先,它丰富了我们对肿瘤进展中蛋氨酸代谢、RNA m6A甲基化和抗肿瘤免疫之间的机制联系的理解。即,蛋氨酸为RNA m6A修饰提供甲基供体,在抗肿瘤免疫和T细胞功能中发挥重要作用。
其次,YTHDF1的表观遗传调控机制涉及调节免疫检查点分子的表达,这表明YTHDF1是一种潜在的免疫治疗效果的生物标志物。鉴于膳食蛋氨酸限制与PD-1抑制剂在不同的小鼠模型中协同作用,膳食蛋氨酸干预的进一步研究可能为癌症免疫治疗的新策略提供线索。
最后,值得期待的是,进一步探索如何在不影响人体正常机能的条件下,通过合理调节蛋氨酸饮食改善CRC患者对ICB疗法的响应率。
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


