深度解读:2020年诺贝尔化学奖授予CRISPR-CAS9基因编辑技术
来源:本站原创 2020-10-07 23:27
2020年10月7日,瑞典皇家科学院已决定将2020年诺贝尔化学奖授予德国马克斯·普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士,以表彰她们在基因编辑领域的贡献。
2020年10月7日讯/生物谷BIOON/---2020年10月7日,瑞典皇家科学院已决定将2020年诺贝尔化学奖授予德国马克斯·普朗克病原学研究所的Emmanuelle Charpentier博士以及美国加州大学伯克利分校的Jennifer A. Doudna博士,以表彰她们在基因组编辑领域的贡献。

(图片来源:NobelPrize.org)
关于两位科学家
Emmanuelle Charpentier,1968年出生于法国奥尔维河畔尤维斯。1995年获得法国巴黎巴斯德研究所博士学位,目前为马克斯·普朗克病原学研究室主任。Jennifer A.Doudna,1964年生于美国华盛顿特区。博士1989年毕业于美国波士顿哈佛医学院。美国加州大学伯克利分校教授,霍华德·休斯医学研究所研究员。
2002年, Emmanuelle Charpentier在维也纳大学成立自己的研究小组时,她专注于对人类造成最大影响的病原体之一:化脓性链球菌。每年,化脓性链球菌感染数以百万计的人,常见症状包括扁桃体炎和脓疱在内,往往容易治愈。但是,它也可能破坏体内的软组织,并且导致危及生命的败血症的发生。为了更好地了解化脓性链球菌,Charpentier希望彻底研究这种细菌的基因是如何进行调控的。这项决定成为了基因编辑技术的起点。
2006年,Jennifer Doudna博士领导的加州大学伯克利分校研究小组正致力于 “RNA干扰” 现象的研究。多年以来,研究人员一直认为他们已经掌握了RNA的基本功能,但此后突然发现了许多新型的小RNA分子,它们有助于调节细胞中的基因活性。
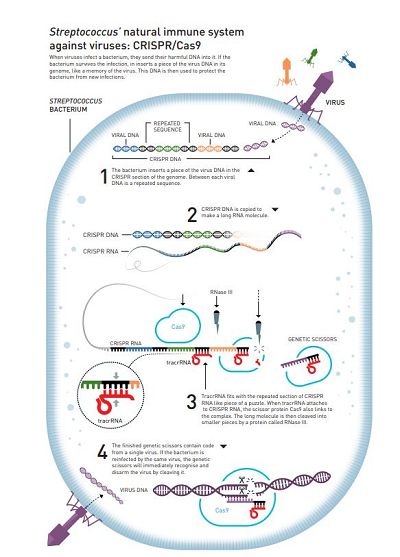
细菌的古老的“免疫系统”
Doudna博士的同事,一名微生物学家,无意间向Doudna讲述了一项新发现:当研究人员比较差异极大的细菌以及古细菌的遗传物质时,他们发现其中的DNA重复序列保存得非常好。相同的代码一遍又一遍地出现,但是其中又有不同的序列。就像在书中的每个句子之间重复相同的单词一样。

(图片来源:NobelPrize.org)
这些重复序列称为“成簇的规则间隔的短回文重复序列(clustered regularly interspaced short palindromic repeats)”,缩写为CRISPR。由于CRISPR中独特的非重复的序列似乎与各种病毒的遗传密码相匹配,因此研究者们认为这是细菌的古老免疫系统的一部分,可以保护细菌和古细菌免受病毒侵害。如果细菌成功地抵抗了病毒感染,它会将一部分病毒的遗传密码添加到其基因组中,作为对感染的记忆。
虽然还没有人知道其中的分子机制,但当前的基本假设是:细菌通过RNA干扰的机制达到中和病毒的目的。
复杂的分子机制图谱
如果细菌被证明确实存在古老的免疫系统,那么将会成为科学界很重要的发现,为此Doudna博士的好奇心开始生起,并且开始学习有关CRISPR系统的一切知识。
(图片来源:NobelPrize.org)
事实证明,除CRISPR序列外,细菌内部还存在一种被称为CRISPR相关,缩写为cas的特殊基因。Doudna博士发现这些基因与编码专门用于解链和切割DNA的蛋白质的基因非常相似。那么Cas蛋白是否具有相同的功能,它们能否切割病毒DNA就成为了新的问题。
几年后,Doudna博士领导的研究小组成功地揭示了几种不同的Cas蛋白的功能。同时,该系统也陆续被其它研究小组发现。细菌的免疫系统可以采取非常不同的形式。下图展示了不同类型的 CRISPR / Cas系统工作机制。Doudna博士所研究的CRISPR / Cas系统属于1类;这是一个复杂的机制,需要许多不同的Cas蛋白来清除病毒。第2类系统非常简单,因为它们需要的蛋白质更少。在世界的另一边, Emmanuelle Charpentier博士刚刚遇到了这样的系统。
CRISPR系统的难题
Emmanuelle Charpentier早期居住在维也纳,但在2009年,她移居到瑞典北部的Umeå大学,拥有良好的研究机会。很多人建议她不要偏远的地方,但是她认为Umeå大学当地漫长而黑暗的冬天让她有长期的平静生活,这对于开展科学研究是十分重要的。
在病原微生物研究工作的同时,Charpentier对参与基因调控的小RNA分子感兴趣。通过与柏林的研究人员合作,Charpentier等人化脓性链球菌内部的小RNA进行了定位。这种细菌中大量存在的小RNA分子之一此前并未被报道,并且其遗传密码非常接近于基因组中的CRISPR序列。
通过仔细分析它们的遗传密码,Charpentier发现这一新型的小RNA分子的一部分与CRISPR基因中的重复序列存在部分匹配。
虽然此前Charpentier从未接触过CRISPR系统。但她的研究小组通过一系列彻底的微生物学检测工作,对化脓性链球菌中的CRISPR系统进行定位。根据目前的研究,已知该系统属于2类,即仅需一个Cas蛋白Cas9即可达到靶向裂解病毒DNA的目的。Charpentier的研究同时表明,未知的RNA分子(称为反式激活的crisp RNA(tracrRNA))对于CRISPR的功能实现具有决定性的意义。它可以帮助基因组中的CRISPR序列转录产生的长RNA分子加工为成熟的,具有活性的形式。
经过深入而有针对性的实验后, Charpentier博士在2011年3月发表了其关于tracrRNA的发现。尽管她在微生物学方面拥有多年经验,但是在继续研究CRISPR-Cas9系统方面,她希望与更加专业的科学家合作。Jennifer Doudna博士因此成为了自然的选择。Charpentier被邀请参加在波多黎各举行的一次会议时,两位科学家进行了一次历史性的会面。
波多黎各的咖啡馆里的会谈改变了“生命”
会议的第二天,她们经同事介绍在一家咖啡馆见面。第二天, Charpentier邀请Doudna博士等人在波多黎各的旧城区游玩,顺便深入交流彼此的研究。Charpentier想知道Doudna是否对这一合作感兴趣,是否想研究化脓性链球菌的基因编辑系统。
Jennifer Doudna对此很感兴趣,他们和他们的同事们通过数字会议为该项目制定了计划。他们猜测细菌需要CRISPR-RNA来识别病毒的DNA序列,而Cas9则是最终切断DNA分子的剪刀。但是,当他们在体外进行测试时,却没有得到预期的结果。
经过大量的头脑风暴和大量失败的实验之后,研究人员终于将tracrRNA添加到他们的系统中。此前,他们认为只有在将CRISPR-RNA切割成其活性形式时才需要tracrRNA(图2)。当Cas9获得tracrRNA时,每个人都在等待的结果终于发生了:DNA分子被切割成两部分。
划时代的实验
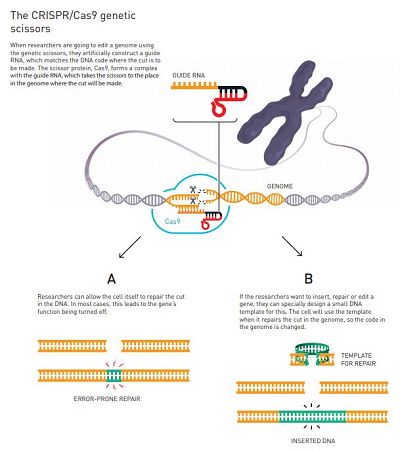
研究人员决定尝试对“遗传剪刀”进行简化。利用他们对tracr-RNA和CRISPR-RNA的新见解,他们成功地将两者融合为一个分子,并将其命名为“Guide RNA”。使用这种遗传剪刀的简化版本,他们进行了一项划时代的实验:是否可以控制这种遗传工具,以便在任意位置切割DNA。
到此时,研究人员知道他们已经十分接近目的。他们从Doudna博士实验室的冰箱中获得了一个基因,并选择了五个可以切割的部位。然后,他们改变剪刀的CRISPR部分,以使其代码与要进行切割的部位的序列相匹配。结果表明, DNA分子能够在正确的位置被切割。
基因剪刀改变了生命科学
在Emmanuelle Charpentier和Jennifer Doudna在2012年发现CRISPR / Cas9基因剪刀后不久,其它几个研究小组证明该工具可用于修饰小鼠和人类细胞的基因组,从而导致其爆炸性的发展。此前,改变细胞,植物或生物体中的基因是一项非常耗时,有时甚至是不可能的完成的工作。使用CRISPR基因编辑工具,研究人员原则上可以在他们想要的任何基因组中进行切割。此后,很容易利用细胞的天然系统对DNA进行修复,从而实现基因的“重定义”。
(图片来源:NobelPrize.org)
由于这种基因工具非常易于使用,因此在基础研究中得到了广泛的应用。例如它可以用于改变细胞和实验动物的DNA,以了解不同基因如何起作用和相互作用。
基因剪刀也已成为植物育种的标准工具。研究人员以前用来修饰植物基因组的方法通常需要添加抗生素抗性基因。种植农作物时,存在这种抗药性扩散到周围微生物的风险。由于有了遗传剪刀,研究人员不再需要使用这些旧方法,而是可以对基因组进行非常精确的修饰。他们编辑了使水稻从土壤吸收重金属的基因,从而改良了水稻,使镉和砷含量降低。研究人员还开发出了能够在温暖的气候下更好地抵抗干旱,抵抗昆虫和害虫的作物。
在医学上,基因剪刀为癌症的新免疫疗法做出了贡献,正在进行使梦想成真的试验-治疗遗传性疾病。研究人员已经在进行临床试验,以研究他们是否可以使用CRISPR / Cas9来治疗镰状细胞性贫血和β地中海贫血等血液疾病以及遗传性眼病。
他们还在开发修复大脑和肌肉等大型器官中基因的方法。动物实验表明,经过特殊设计的病毒可以将遗传剪刀传递给所需的细胞,从而治疗毁灭性遗传疾病的模型,例如肌肉营养不良,脊髓性肌肉萎缩和亨廷顿舞蹈病。但是,该技术需要进一步完善,才能在人体上进行测试。
“基因剪刀”的力量需要监管
除了其所有优点之外,遗传剪刀也可能存在被滥用的风险。例如,该工具可用于创建转基因胚胎。但是,多年来,有控制基因工程应用的法律和法规,其中包括禁止以允许遗传改变的方式修改人类基因组。另外,涉及人畜的实验必须在进行伦理委员会之前进行审查和批准。
可以肯定的是:这些遗传剪刀影响着我们所有人。我们将面临新的道德问题,但是这种新工具可能有助于解决人类目前面临的许多挑战。通过Emmanuelle Charpentier和Jennifer Doudna的新发现,生命科学成功进入了一个新时代。当我们具有了此前不曾拥有过的强大能力后,将在未来探索生命科学“新大陆”时做出更多伟大的发现。(生物谷 Bioon.com)
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
87%用户都在用生物谷APP 随时阅读、评论、分享交流 请扫描二维码下载->


