IF=53!陆军军医大学吴玉章团队合作取得新进展
来源:iNature 2025-12-05 09:19
该研究发现肥胖过程中增厚脂肪细胞中β2-微球蛋白表达上调,不仅以细胞接触依赖的方式介导了脂肪驻留CD8+ T细胞的活化,而且促进了铁超载和脂肪细胞的铁凋亡,从而促进了脂肪组织巨噬细胞的M1极化。
脂肪组织中的慢性炎症被广泛认为是肥胖症与一系列相关慢性疾病(包括2型糖尿病、非酒精性脂肪性肝病和心血管疾病)之间的关键联系。在这一致病过程中,脂肪细胞与脂肪驻留免疫细胞之间失调的相互作用起着关键的调节作用;然而,控制这种异常相互作用的潜在机制在很大程度上仍然未知。
2025年12月3日,陆军军医大学吴玉章团队合作在Signal Transduction and Targeted Therapy 在线发表题为Adipocytes orchestrate obesity-related chronic inflammation through β2-microglobulin的研究论文,该研究发现肥胖过程中增厚脂肪细胞中β2-微球蛋白表达上调,不仅以细胞接触依赖的方式介导了脂肪驻留CD8+ T细胞的活化,而且促进了铁超载和脂肪细胞的铁凋亡,从而促进了脂肪组织巨噬细胞的M1极化。
相反,在脂肪细胞中特异性消融β2-微球蛋白可有效抑制脂肪驻留CD8+ T细胞的激活和积累,抑制脂肪细胞铁下沉和M1极化,最终预防高脂饮食引起的肥胖及其相关炎症和代谢紊乱。
腺相关病毒介导的脂肪靶向β2微球蛋白的敲低已被证明可以治疗性地缓解高脂肪饮食引起的肥胖,以及相关的慢性炎症和代谢紊乱。此外,对人类脂肪转录组数据的生物信息学分析显示,脂肪β2-微球蛋白与肥胖之间存在很强的相关性。更重要的是,β2-微球蛋白在肥胖患者分离的脂肪细胞中显著上调。因此,该研究结果强调了脂肪细胞通过β2微球蛋白依赖机制在肥胖相关的慢性炎症和代谢紊乱中的关键作用。

肥胖是一种慢性代谢性疾病,其特征是体内脂肪堆积过多和/或脂肪组织分布异常。它已成为全球主要的公共卫生问题,并作为许多慢性疾病的共同病理生理基础。据估计,全球成年人中超重的患病率接近50%,肥胖近年来已成为全球公共卫生的一个主要挑战。
令人担忧的是,高身体质量指数(BMI,≥25)越来越被认为是一系列非传染性疾病的一个重要危险因素,包括代谢性疾病(例如,2型糖尿病;与代谢功能障碍相关的脂肪性肝病(MAFLD)、心血管疾病(如高血压、冠心病和中风)、呼吸系统疾病(如哮喘和阻塞性睡眠呼吸暂停综合征)、恶性肿瘤(如乳腺癌和结直肠癌)和精神健康障碍(如抑郁和焦虑)。
脂肪组织的慢性炎症是一种起源于脂肪组织的持续性、低度、全身性炎症,其特征是过度的脂质积累。它可累及肝脏、骨骼肌、胰岛、中枢神经系统等多器官,在肥胖相关代谢并发症的发病机制中起关键作用。因此,阐明驱动慢性脂肪组织炎症的潜在启动机制,对于有效预防和管理与肥胖相关的代谢综合征至关重要。然而,目前对这些炎症级联反应的调节机制的理解仍然不足。
脂肪组织的组成是复杂的,三分之一是成熟的脂肪细胞,其余成分包括前脂肪细胞、成纤维细胞、内皮细胞和免疫细胞,统称为基质血管部分(SVF)。存在于脂肪组织中的免疫细胞在肥胖相关炎症和代谢紊乱的发病机制中起着关键作用。
早期对脂肪组织驻留免疫细胞的研究已经确定脂肪组织巨噬细胞(ATMs)是炎症反应的中心介质。ATMs是脂肪组织中最丰富的免疫细胞,在肥胖病理条件下受到动态调控:如CC基序配体-2/趋化因子受体2型趋化因子轴介导循环单核细胞向肥胖脂肪组织的浸润。
这些浸润性单核细胞是ATMs的重要细胞来源,它们与ATMs的大量增殖一起导致ATMs积累的大量增加。同时,ATMs经历从抗炎M2状态到促炎M1表型的表型转变,从而导致肥胖相关的慢性炎症和代谢紊乱。
M1巨噬细胞可以分泌高水平的促炎细胞因子,包括干扰素γ (IFNγ)和白细胞介素-1β (IL-1β),从而加剧脂肪组织炎症,并通过循环促进全身低度炎症,最终导致代谢功能障碍。尽管越来越多的人认识到ATMs在肥胖诱导的代谢并发症中的关键作用,但对肥胖条件下ATMs炎症激活的机制的理解仍然不完整和不清楚。
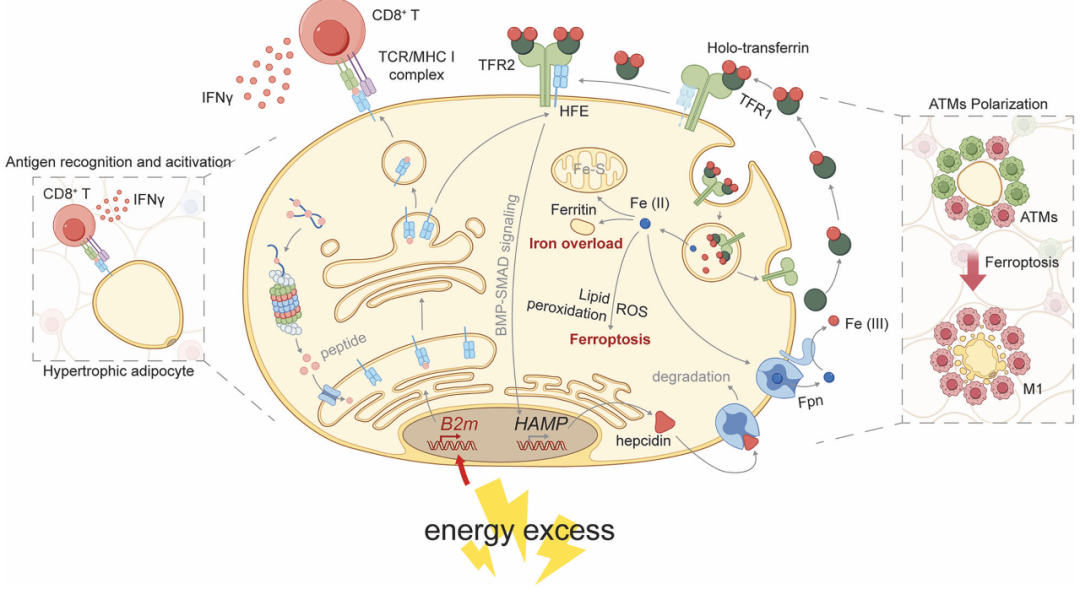
肥厚脂肪细胞诱导慢性脂肪炎症和与肥胖相关的代谢紊乱的机制示意图(图源自Signal Transduction and Targeted Therapy )
近年来,脂肪驻留T细胞在调节与肥胖相关的脂肪组织慢性炎症中的作用越来越得到证实,为这一研究领域提供了新的见解。例如,CD8+ T细胞是肥胖开始时脂肪组织中最早激活的免疫细胞之一,在肥胖相关炎症反应的早期阶段发挥关键作用。
一方面,它们分泌促炎细胞因子,不仅促进ATMs向脂肪组织募集,而且诱导ATMs向M1型极化;另一方面,它们可以直接参与炎症信号的放大,共同将它们定位为肥胖相关慢性炎症的关键驱动因素。尽管脂肪驻留免疫细胞在肥胖相关慢性炎症和代谢紊乱中的核心作用已被明确证实,但在肥胖条件下驱动这些免疫细胞表型重塑和炎症激活的分子机制仍未完全阐明。
脂肪细胞不仅负责营养物质的储存和供应,而且在调节全身能量平衡方面起着至关重要的作用。肥厚性脂肪细胞被认为与肥胖相关的慢性炎症和代谢紊乱密切相关。
在肥胖中,肥厚性脂肪细胞经历缺氧应激、内质网应激或多种代谢途径失调,如磷酸肌酸/肌酸和谷氨酰胺代谢,主要通过与脂肪常驻免疫细胞的相互作用促进肥胖相关慢性炎症的发展。然而,肥厚脂肪细胞在脂肪驻留免疫细胞炎症激活中的确切作用和机制仍不完全清楚。
该研究发现了一个以前未被认识到的脂肪细胞在脂肪驻扎免疫细胞的炎症激活中的作用,以促进肥胖相关的慢性炎症和代谢紊乱,这是通过β2微球蛋白(B2M)依赖机制介导的,涉及主要组织相容性复合体I类(MHC-I)抗原呈递和铁运输。
研究人员相信这些发现不仅显著推进了对由脂肪细胞失调驱动的慢性脂肪炎症的理解,而且为控制肥胖及其代谢并发症提供了潜在的新治疗靶点。
https://www.nature.com/articles/s41392-025-02486-3
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


