Cell Death & Differentiation: 靶向免疫抑制的RBMS1或是针对三阴性乳腺癌的免疫治疗策略
来源:生物谷原创 2022-05-25 18:52
癌症免疫疗法,包括免疫检查点阻断和CAR-T疗法,已被广泛应用于多种癌症。然而,免疫寒性肿瘤(如乳腺癌)对免疫治疗的临床反应相当差。
癌症免疫疗法,包括免疫检查点阻断和CAR-T疗法,已被广泛应用于多种癌症。然而,免疫寒性肿瘤(如乳腺癌)对免疫治疗的临床反应相当差。尽管一些侵袭性的三阴性乳腺癌(TNBC)是免疫原性的,但大多数TNBC患者表现出有限的反应,特别是当肿瘤缺乏肿瘤浸润性淋巴细胞(TIL)时,无法激发抗肿瘤免疫。
因此,寻找合适的靶点来增强肿瘤细胞的免疫原性,将为提高抗肿瘤免疫活性提供新的途径。
免疫治疗已广泛应用于多种肿瘤的治疗,但对三阴性乳腺癌(TNBC)的治疗效果仍受到质疑。同时,RNA结合蛋白在调节TNBC免疫治疗中的功能和机制在很大程度上仍然不清楚。
近日,大连医科大学的研究者们在Cell Death & Differentiation杂志上发表了题为“Loss of RBMS1 promotes anti-tumor immunity through enabling PD-L1 checkpoint blockade in triple-negative breast cancer”的文章,该研究发现通过靶向免疫抑制的RBMS1提供了一种新的针对TNBC的免疫治疗策略。

图片来源: https://doi.org/10.1038/s41418-022-01012-0
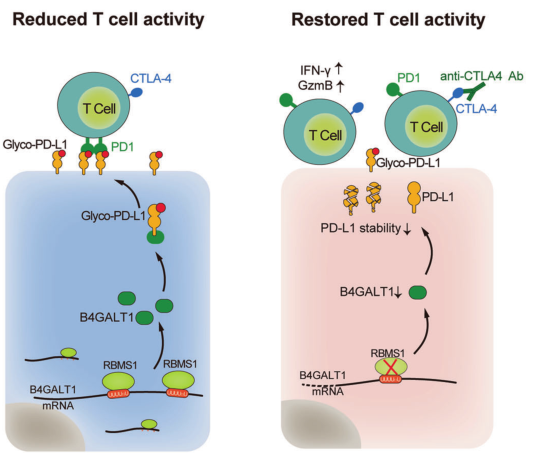
在此,研究者报道了RNA结合蛋白RBMS1在免疫寒冷的TNBC中普遍存在。通过系统的shRNA介导的筛选,研究者发现RBMS1的缺失显著降低了TNBC中程序性死亡配体1(PD-L1)的水平。
临床上,乳腺癌患者RBMS1水平升高,且与PD-L1水平呈正相关。RBMS1消融刺激细胞毒性T细胞介导的抗肿瘤免疫。从机制上讲,RBMS1调节新发现的PD-L1糖基转移酶B4GALT1的mRNA稳定性。
RBMS1的缺失破坏了B4GALT1的mRNA的稳定性,抑制了PD-L1的糖基化,促进了PD-L1的泛素化和随后的降解。重要的是,RBMS1缺失与CTLA4免疫检查点阻断或CAR-T治疗相结合,在体外和体内都增强了抗肿瘤T细胞免疫。
RBMS1缺失增强B7-H3CAR-T细胞靶向人TNBC的抗肿瘤活性
图片来源: https://doi.org/10.1038/s41418-022-01012-0
总之,研究者报告了RBMS1消融通过抑制PD-L1糖基化来降低PD-L1水平,从而增强抗CTLA4和CAR-T免疫疗法的疗效。因此,本研究揭示了一种通过RNA结合蛋白调节PD-L1水平的新的分子机制,该机制有可能通过将RBMS1缺失与CTLA4免疫检查点阻断或CAR-T治疗相结合来开发针对人TNBC的联合癌症免疫疗法。(生物谷 Bioon.com)
参考文献
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


